
[选修一物质结构与性质] (15分)
有X、Y、Z、Q、M 、E、N、G前四周期且原子序数递增的八种元素,其中X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素基态原子核外有两个电子层,最外层有3个未成对电子,Q的基态原子核外成对电子数是成单电子数的3倍,E原子得到一个电子后3p轨道全充满,G+中所有电子正好全部充满K、L、M三个电子层。M、N原子的价层电子构型为nS1,其电离能数据如下表:
| | M | N |
| 第一电离能(kJ/mol) | 495.8 | 418.8 |
 键, 个
键, 个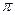 键:
键:
科目:高中化学 来源: 题型:
| 3 |
| ||
| 3 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 氟化物 | AF | BF2 | DF4 |
| 熔点/K | 1266 | 1534 | 183 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
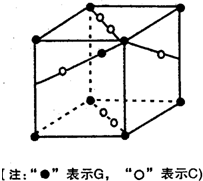 (2010?宝鸡三模)[化学-选修3物质结构与性质]
(2010?宝鸡三模)[化学-选修3物质结构与性质]查看答案和解析>>
科目:高中化学 来源: 题型:
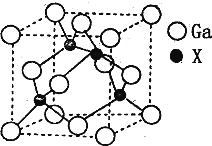
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com