
| A. | A>B>D>C | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
分析 活泼性较强的金属作原电池的负极,易失去电子而被氧化;原电池中电子从负极流经外电路流向正极,电流从正极沿外电路流向负极;原电池正极上得电子生成气体或析出单质,以此可确定金属的活泼性强弱.
解答 解:①活泼性较强的金属作原电池的负极,A、B用导线相连后,同时插入稀H2SO4中,A极为负极,则活泼性:A>B;
②C、D用导线相连后,同时浸入稀硫酸中,电子由负极→导线→正极,电流方向与电子方向相反,电流由正极C→导线→负极D,则活泼性D>C;
③A、C相连后,同时浸入稀硫酸中,C极产生大量气泡,说明C为原电池的正极,较不活泼,则活泼性:A>C;
④B、D相连后,同时浸入稀H2SO4溶液中,B极发生氧化反应,说明B为原电池的负极,则活泼性B>D;
所以有:A>B>D>C,
故选A.
点评 本题考查金属活泼性的比较,侧重于学生的分析能力的考查,题目难度不大,本题注意把握如何从原电池的角度比较金属的活泼性,原电池中,较为活泼的金属作负极


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
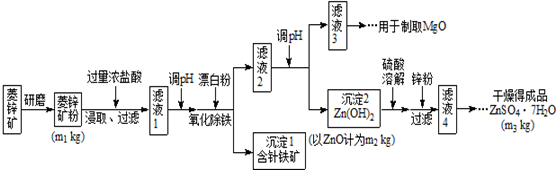
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度(℃) | Na2S2O3溶液 | H2SO4溶液 | H2O的体积 | 出现沉淀所需时间 | |||
| 体积 | 浓度 | 体积 | 浓度 | ||||
| A | 0 | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | |
| B | 0 | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | |
| C | 30 | 5mL | 0.1mol/L | 5mL | 0.1mol/L | 10mL | |
| D | 30 | 5mL | 0.1mol/L | 10mL | 0.1mol/L | 5mL | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔沸点由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 沸点由高到低:HI>HBr>HCl>HF | |
| D. | 硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| D. | 熔点:对二甲苯>邻二甲苯>间二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| B. | 构成单质分子的粒子之间不一定存在共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 阴、阳离子间通过离子键一定能形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.4mol•L-1 | B. | X2为0.2 mol•L-1 | C. | Y2为0.4 mol•L-1 | D. | Z为0.3 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com