
按要求完成下列问题:
(1)在25℃、101kPa下,1g甲醇(液体,分子式为CH3OH)燃烧生成CO2和液态水时放热22.68kJ.则表示甲醇燃烧热的热化学方程式为 ;将该反应设计成碱性燃料电池,写出该电池的负极电极反应方程式
(2)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ•mol﹣1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=﹣247.4kJ•mol﹣1
以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 .
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=﹣2986kJ•mol﹣1
4P(s,红磷)+5O2=P4O10(s);△H=﹣2956kJ•mol﹣1
则白磷比红磷 (填“稳定”或“不稳定”)
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g) 的△S= 0,△H 0 (填“<”、“>”、“=”)
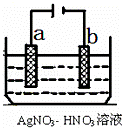
(5)如图为电解精炼银的示意图, a (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 .
考点:
原电池和电解池的工作原理;热化学方程式;电解原理.
专题:
基本概念与基本理论.
分析:
(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,题干所给量计算32g甲醇燃烧生成二氧化碳和液态水放热,结合热化学方程式书写方法,标注物质聚集状态和对应焓变;碱性燃料电池中,甲醇在负极失电子生成碳酸根离子;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(3)根据物质的总能量与反应热的关系判断,能量越高物质越不稳定;
(4)反应自发进行的判断依据是△H﹣T△S<0,反应自发进行,△H﹣T△S>0,反应非自发进行;据此判断;
(5)电解精炼时,含有杂质的金属作阳极;若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮.
解答:
解:(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ.32g甲醇燃烧生成二氧化碳和液态水放出热量为725.76KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+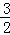 O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJ•mol﹣1,碱性燃料电池中,甲醇在负极失电子生成碳酸根离子,其电极方程式为CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;
O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJ•mol﹣1,碱性燃料电池中,甲醇在负极失电子生成碳酸根离子,其电极方程式为CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;
故答案为:CH3OH(l)+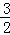 O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJ•mol﹣1;CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;
O2(g)=CO2(g)+2H2O(l)△H=﹣725.76kJ•mol﹣1;CH3OH﹣6e﹣+8OH﹣═CO32﹣+6H2O;
(2)①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ•mol﹣1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=﹣247.4kJ•mol﹣1
①×2﹣②得到CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=206.2×2﹣(﹣247.4)=+659.8kJ•mol﹣1 ;
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+659.8kJ•mol﹣1;
(3)已知白磷、红磷燃烧的热化学方程式分别为:
P4(s,白磷)+5O2=P4O10(s);△H=﹣2986kJ•mol﹣1
4P(s,红磷)+5O2=P4O10(s);△H=﹣2956kJ•mol﹣1
等质量的白磷和红磷完全燃烧,白磷放出的热量多,相同的状况下,白磷的能量比红磷高,则白磷比红磷不稳定,
故答案为:不稳定;
(4)已知一定条件下A2与B2自发反应生成AB3,则反应A2(g)+3B2(g)=2AB3(g),该反应正方向为物质的量减小的方向,则△S<0,一定条件下能自发进行,则
△H﹣T△S<0,所以<0,
故答案为:<;<;
(5)电解精炼时,粗银作阳极,纯银作阴极,所以a极为含有杂质的粗银,若阴极有少量红棕色气体生成,说明阴极上硝酸根离子得电子生成二氧化氮,电极反应式为:2H++NO3﹣+e﹣=NO2↑+H2O,
故答案为:a;2H++NO3﹣+e﹣=NO2↑+H2O.
点评:
本题考查了化学反应与能量、盖斯定律的应用、燃料电池电极方程式的书写、反应自发性的判断、电解原理的应用等,题目涉及的知识点较多,题目难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
下列说法正确的是()
A. 增大压强,活化分子数增加,化学反应速率一定增大
B. 升高温度,活化分子百分数增加,化学反应速率一定增大
C. 活化分子间所发生的分子间的碰撞为有效碰撞
D. 加入反应物,使活化分子百分数增加,化学反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10mol•L﹣1 NaHCO3溶液的说法正确的是()
A. 溶质的电离方程式为NaHCO3═Na++H++CO32﹣
B. 25℃时,加水稀释后,n(H+)与n(OH﹣)的乘积变大
C. 离子浓度关系:c(Na+)+c(H+)=c(OH﹣)+c(HCO3﹣)+c(CO32﹣)
D. 温度升高,c(HCO3﹣)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
|
| A. | H2O(g)=H2(g)+ |
|
| B. | 2H2(g)+O2(g)=2H2O(l)△H=﹣484kJ•mol﹣1 |
|
| C. | H2(g)+ |
|
| D. | 2H2(g)+O2(g)=2H2O(g)△H=+484kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
|
| A. |
FeCl3+3KSCN⇌Fe(SCN)3+KCl(忽略液体体积变化) |
|
| B. |
2NO+O2⇌2NO2△H<0 |
|
| C. |
NO(g)+CO(g)⇌ |
|
| D. |
A2(g)+3B2(g)⇌2AB3(g)△H=﹣373.4KJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对于“摩尔”的理解正确的是( )
-A.-摩尔是国际科学界建议采用的一种物理量
-B.-摩尔是物质的量的单位,简称摩,符号为mol
-C.-摩尔可以把物质的宏观数量与微观粒子的数量联系起来
-D.-国际上规定,0.012kg碳原子所含有的碳原子数目为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关气体体积的叙述正确的是( )
-A.-一定温度和压强下,各种气态物质的体积大小,由构成气体的分子大小决定的
-B.-不同的气体,若体积不同,则他们的分子数也不同
-C.-一定温度和压强下,各种气态物质的体积大小,由构成气体的分子数决定的
-D.-气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是( )
|
| A. | 应使混合物中的水分完全蒸干后,才能停止加热 |
|
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
|
| C. | 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中 |
|
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com