
| A. | H2S气体能用浓硫酸进行干燥(浓硫酸的吸水性) | |
| B. | 铜与浓硝酸制备NO2气体(浓硝酸的强氧化性、酸性) | |
| C. | SO2的水溶液能够使品红溶液褪色(H2SO3的强氧化性) | |
| D. | 可口可乐瓶盖打开后,有大量气体逸出(H2CO3的挥发性) |
分析 A、H2S与浓硫酸发生氧化还原反应;
B、硝酸与铜反应氮的化合价部分变化;
C、SO2的水溶液能够使品红溶液褪色,体现二氧化硫的漂白性;
D、体现二氧化碳的溶解性.
解答 解:A、H2S与浓硫酸发生氧化还原反应,所以不能用浓硫酸干燥硫化氢,体现浓硫酸的强氧化性,故A错误;
B、硝酸与铜反应氮的化合价部分变化,所以体现浓硝酸的强氧化性和酸性,故B正确;
C、SO2的水溶液能够使品红溶液褪色,体现二氧化硫的漂白性,而不是H2SO3的强氧化性,故C错误;
D、可口可乐瓶盖打开后,有大量气体逸出,体现二氧化碳的溶解性减小,而不是H2CO3的挥发性,故D错误;
故选B.
点评 本题考查化学实验方案的评价,涉及氧化还原反应、二氧化硫和铝的溶解性等,熟悉物质的性质是解题关键,注意二氧化硫的还原性和漂白性,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:实验题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
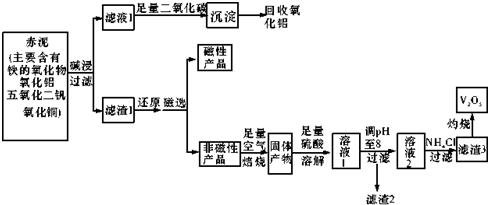
| 物质 | V205 | NH4V03 | (V02)2S04 |
| 溶解性 | 难溶 | 难溶 | 易溶 |
| Cu2+ | Fe2+ | Fe3+ | |
| 开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
| 完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
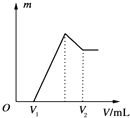 将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL、2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com