
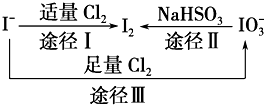
 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )| A、海带中提取碘过程中,将I-氧化成I2所通入的Cl2不宜过量 |
| B、足量Cl2能使湿润的KI淀粉试纸先变蓝后变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| ② |
| 操作A |
| ③ |
| 操作A |
| ④ |
| 操作A |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、立即打开门窗通风 |
| B、将中毒者转移到空旷的地带 |
| C、立即打开排气扇将CO排出 |
| D、给危重病人及时输氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.0 mol/L |
| B、8.8 mol/L |
| C、9.0 mol/L |
| D、9.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两溶液中水电离出的c(H+)=1×10-11mol?L-1 |
| B、加水稀释100倍后两溶液pH仍相同 |
| C、醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相同 |
| D、两溶液中分别加入足量锌片放出H2体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com