
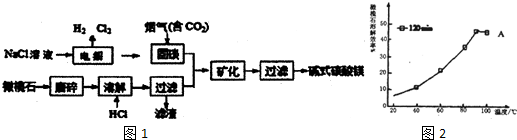
分析 由流程可知,氯化钠溶液电解得到氯气、氢气和氢氧化钠溶液,利用氢氧化钠溶液固碳,生成碳酸盐,橄榄石的主要成分为Mg2SiO4,磨碎加入盐酸溶解过滤得到滤液和碳酸盐混合矿化得到碱式碳酸镁,
(1)根据能和二氧化碳之间反应的物质能来固定二氧化碳来回答;
(2)依据影响反应速率因素分析判断,升温、增大浓度,增大接触面积会提高反应速率;温度对化学反应平衡移动的影响知识分析90%橄榄石溶解效率开始降低的原因;
(3)A是否洗净是利用实验检验最后一次洗涤液中是否含有氯离子,氯离子的检验用硝酸酸化的硝酸;
(4)理论上此工厂1小时排放烟气22.4m3/min×60min,其中二氧化碳体积=22.4m3/min×60min×15%,据此计算二氧化碳物质的量,结合碳元素守恒计算碱式碳酸镁的质量.
解答 解:(1)固碳时发生的主要反应的化学方程式为氢氧化钠和二氧化碳反应生成碳酸氢钠或生成碳酸钠,反应的化学方程式为:NaOH+CO2=NaHCO3或写为2NaOH+CO2=Na2CO3+H2O,所给的物质中,Na2CO3和NH3•H2O可以和二氧化碳之间反应,能用作“固碳”的试剂,
故答案为:NaOH+CO2=NaHCO3或2NaOH+CO2=Na2CO3+H2O;ac;
(2)为提高HC1溶液溶解橄榄石的效率,可采取的措施适当提高温度,适当增大HCl溶液的浓度或搅拌或增大接触面积等,程中将橄榄石磨碎后再进行溶解的目的是增大接触面积,加快溶解速率,图2中所示数据以及曲线变化知道,20min后,溶解达到平衡,而该反应是放热,升温,平衡逆向移动,则溶解效率降低,
故答案为:增大接触面积,加快溶解速率;90℃、120min时,溶解达到平衡,而反应放热,升温平衡逆向移动,故溶解效率降低;
(3)判断产品洗净只需要检验洗涤液中不含有氯离子即可,氯离子的检验用硝酸酸化的硝酸银,操作是:取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,如无沉淀产生,则已洗净,
故答案为:取少量最后一次的洗涤液,加硝酸酸化的硝酸银溶液,若无沉淀产生,则已洗净;
(4)理论上此工厂1小时排放烟气22.4m3/min×60min,其中二氧化碳体积=22.4m3/min×60min×15%,二氧化碳物质的量等于碱式碳酸镁的物质的量=$\frac{22.4{m}^{3}/min×60min×15%×1000L/{m}^{3}}{22.4L/mol}$,碱式碳酸镁的质量=$\frac{22.4{m}^{3}/min×60min×15%×1000L/{m}^{3}}{22.4L/mol}$×142g/mol=1278000g=1278kg,
故答案为:1278.
点评 本题考查了物质分离提纯的分析判断,主要是试剂选择和过程分析判断,离子检验方法,元素守恒的计算应用,掌握基础是关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA | |
| B. | 0.5 mol苯分子中含有C=C双键数为1.5 NA | |
| C. | 1 mol甲基(-CH3)所含的电子总数为10 NA | |
| D. | 标准状况下,1L甲醇完全燃烧后生成的CO2分子数目约为$\frac{{N}_{A}}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,结构简式H2C=CH2.
,结构简式H2C=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离 子 | 要 求 |
| A | NH4+、Al3+、SO42-、H+ | 滴加NaOH溶液立刻有气体产生 |
| B | K+、NO3-、Cl-、HS- | c(K+)<c(Cl-) |
| C | Fe2+、NO3-、SO42-、Cl- | 逐滴滴加盐酸时溶液没有颜色变化 |
| D | Na+、HCO3-、Mg2+、SO42- | 滴加氨水立即有沉淀产生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com