
| A. | 中和反应是吸热反应 | |
| B. | 燃烧属于放热反应 | |
| C. | 断裂化学键要放出能量 | |
| D. | 反应物总能量一定等于生成物总能量 |
分析 A、中和反应是酸和碱发生的反应,是放热反应;
B、燃烧是可燃物发生的剧烈的发光放热的反应,是放热反应;
C、断裂化学键需要吸收能量;
D、化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等.
解答 解:A、中和反应是酸和碱发生的反应,是放热反应,故A错误;
B、燃烧是可燃物发生的剧烈的发光放热的反应,是放热反应,故B正确;
C、断裂化学键需要吸收能量,故C错误;
D、化学反应过程中一定伴随能量的变化,反应物总能量与生成物总能量一定不相等,故D错误;
故选B.
点评 本题考查了反应热效应的分析判断,燃烧、中和热概念的应用,化学反应一定伴随能量变化,化学键的断裂过程是吸热过程,概念理解是解题关键.


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源: 题型:选择题
| 编组 | 强电解质 | 弱电解质 | 非电解质 |
| A | NaCl | HF | Cl2 |
| B | Ba(OH)2 | H2S | C2H5OH |
| C | H2SO4 | CaCO3 | CCl4 |
| D | AgCl | HClO | Cu |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性强弱:NaOH>Mg(OH)2>Al(OH)3 | B. | 热稳定性:HF>HCl>H2S>PH3 | ||
| C. | 微粒半径:Na+>Mg2+>Al3+>F- | D. | 熔点:SiO2>NaCl>I2>CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L | B. | 1.8mol/L | C. | 2.4 mol/L | D. | 3.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
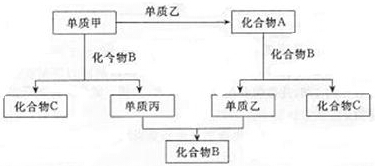
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③
③ ④
④ ⑤
⑤ ⑥
⑥
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成64 g SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 在此反应中,浓硫酸表现出酸性和氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
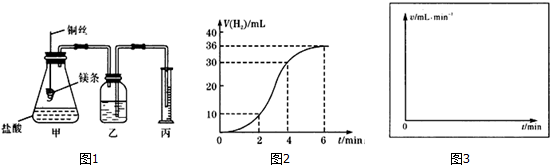
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
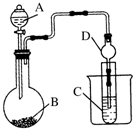 某化学兴趣小组利用如图装置验证元素非金属性的变化规律.
某化学兴趣小组利用如图装置验证元素非金属性的变化规律.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com