
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni且均显+2价,下同)由铁酸盐(MFe2O4)经高温还原而得。常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
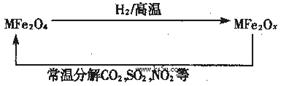
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为 2︰1,则还原产物 MFe2Ox 中x=______,MFe2Ox 中+2价铁与+3价铁的量之比为_____。
(2)在酸性溶液中,Fe2O42-易转化为Fe2+:Fe2O42-+2e-+8H+→2Fe2++4H2O有 KMnO4、Na2CO3、Cu2O、Fe2(SO4)3 四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式并配平_________________。
【知识点】计算、氧化还原反应 A1 B3 B1
【答案解析】(1)3.5 1:1 (每空2分)
(2)Fe2O42-+Cu2O+10H+=2Fe2++2Cu2++5H2O (3分)
解析:(1)根据元素化合价代数和为0知化合物MFe2O4中铁元素的化合价为+3(设Fe的化合价为x,则+2+2x+(-2×4)=0,x=+3),1mol氢气在反应中失去电子2mol,则2mol MFe2O4中的Fe得到电子2mol,即只有2molFe3+得到电子,则MFe2Ox中的2个Fe,1个是+2价,1个是+3价,因此x=3.5,MFe2Ox 中+2价铁与+3价铁的量之比为1:1.
⑵由于Fe2O42-转化为Fe2+是还原反应,因此需加还原剂,即加Cu2O,反应为Fe2O42-+Cu2O+10H+=2Fe2++2Cu2++5H2O。
【思路点拨】本题⑵的氧化还原反应的配平:首先根据氧化还原反应得失电子相等配平氧化剂、还原剂、氧化产物和还原产物Fe2O42-+Cu2O=2Fe2++2Cu2+,再根据电荷守恒确定左边加10个H+,最后根据原子守恒配平。


科目:高中化学 来源: 题型:
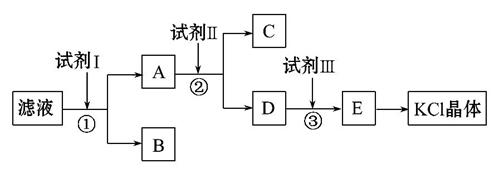
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。
回答下列问题:
(1)起始滤液的pH__________7(填“大于”“小于”或“等于”),其原因是______________________________________________;
(2)试剂Ⅰ的化学式为______________,①中发生反应的离子方程式为______
__________________________________________________________________;
(3)试剂Ⅱ的化学式为______________,②中加入试剂Ⅱ的目的是__________
__________________________________________________________________;
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为___________
__________________________________________________________________;
(5)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用0.100 0 mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为________(列式并计算结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子方程式与所述事实相符且正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C. (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2: Fe2++2OH - =Fe(OH)2
D. C12通入澄清石灰水中:C12+2OH - =C1-+CIO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式___________________________
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
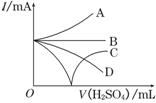
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是 ( )
A.氯化铝溶液中加入过量的氨水:Al3++4 NH3·H2O=AlO2-+4 NH4+
B.稀硝酸中加入过量铁粉:Fe+4H++NO3- = Fe3++NO↑+2H2O
C.二氧化锰与浓盐酸混合加热:MnO2+4H++2Cl- △ Mn2++ Cl2↑+2H2O
D.石灰水中加入过量小苏打溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
当1 mol某气态烃与2 mol Cl2发生加成反应时,分子中的不饱和碳原子全部转化为饱和碳原子,所得产物再与2 mol Cl2进行取代反应后,生成只含C、Cl两种元素的化合物。则该气态烃是( )
A.乙烯 B.乙炔 C.丙烯 D.丙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
不论以何种比例混合,只要混合物的质量一定,完全燃烧后生成CO2的量也一定的一组物质是( )
A.甲苯和乙苯 B.乙烯和丁烯
C.甲烷和丙烯 D.乙炔和丁炔
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气是重要的化工原料
(1)已知: N2(g)+O2(g)=2NO(g) △H= +180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -905kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H= -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式: ;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为 。
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式: ,
科学家利用此原理,设计成氨气一氧气燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(3)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
a.增大压强 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(4)如果某氨水的电离程度为1%,浓度为0.01 mol/LMgCl2溶液滴加氨水至开始产生沉淀时(不考虑溶液体积变化),溶液中的NH3·H2O的浓度为 {已知Ksp[Mg(OH)2]=4.0×10-12]}
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com