
脱硫技术能有效控制SO2对空气的污染。
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
_______________________________。
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42—、Br-、HCO3—等。含SO2的烟气可利用海水脱硫,其工艺流程如图所示:

①向曝气池中通入空气的目的是_____________________________________。
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是________。
a.Cl- b.SO42— c.Br- d.HCO3—
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可得到NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。

①图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
②SO32—放电的电极反应式为____________________________。
③电解过程中阴极区碱性明显增强,用平衡移动的原理解释原因:
__________________________________________。
(1)2SO2+O2+2CaCO3 2CaSO4+2CO2
2CaSO4+2CO2
(2)①将H2SO3、HSO3—等氧化为SO42— ②bd
(3)①负 硫酸
②SO32—-2e-+H2O=SO42—+2H+
③H2O H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
【解析】(1)煤燃烧时,石灰石在高温下分解产生CaO和CO2,CaO为碱性氧化物,可以与SO2、O2反应生成CaSO4,该反应的化学方程式是2SO2+O2+2CaCO3 2CaSO4+2CO2。(2)SO2为酸性氧化物,海水呈弱碱性,曝气池中通入空气的目的是将SO32—、HSO3—等氧化。通入空气后溶液中SO42—的浓度增大,HCO3—的浓度减小。(3)电解Na2SO3溶液,根据图示,a极应为阴极,要连接电源的负极,C口流出的物质是硫酸。阴极的电极反应式为2H++2e-=H2↑,阳极的电极反应式为SO32—-2e-+H2O=SO42—+2H+。电解过程中H+在阴极放电生成H2,阴极区存在平衡H2O
2CaSO4+2CO2。(2)SO2为酸性氧化物,海水呈弱碱性,曝气池中通入空气的目的是将SO32—、HSO3—等氧化。通入空气后溶液中SO42—的浓度增大,HCO3—的浓度减小。(3)电解Na2SO3溶液,根据图示,a极应为阴极,要连接电源的负极,C口流出的物质是硫酸。阴极的电极反应式为2H++2e-=H2↑,阳极的电极反应式为SO32—-2e-+H2O=SO42—+2H+。电解过程中H+在阴极放电生成H2,阴极区存在平衡H2O H++OH-,c(H+)减小,水的电离平衡正向移动,碱性增强。
H++OH-,c(H+)减小,水的电离平衡正向移动,碱性增强。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题1物质的组成分类性质及化学用语练习卷(解析版) 题型:选择题
下列物质的分类标准正确的是( )。
A.强碱和弱碱:电离出的OH-数目
B.强电解质和弱电解质:溶液的导电能力强弱
C.浊液、胶体、溶液:分散剂粒子直径大小
D.氧化剂、还原剂:在化学反应中元素的化合价变化
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题10常见非金属元素及其重要化合物练习卷(解析版) 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空:
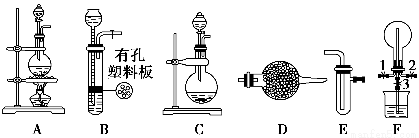
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3===N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子______________________________________________________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式________________________________________________________________。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷(解析版) 题型:实验题
无水FeCl3呈棕红色,极易潮解,100℃左右时升华,工业上常用作有机合成催化剂。实验室可用下列装置(夹持仪器略去)制备并收集无水FeCl3。

请回答:
(1)装置A中反应的离子方程式为__________________________________________。
(2)装置F中所加的试剂为_________________________________________________。
(3)导管b的作用为_____________________________________________________;
装置B的作用为________________________________________________________。
(4)实验时应先点燃A处的酒精灯,反应一会儿后,再点燃D处的酒精灯,原因为_______________________________________________________。
(5)反应结束后,拆卸装置前,必须进行的操作是_________________________________
(6)为检验所得产品中是否含有FeCl2,可进行如下实验:取E中收集的产物少许,加水溶解,向所得溶液中加入一种试剂,该试剂为________(填序号)。
①Fe粉 ②KSCN溶液 ③酸性KMnO4溶液 ④NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 有机推断练习卷(解析版) 题型:填空题
已知:
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:

(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是________,由C→B的反应类型为________。
(3)由A催化加氢生成M的过程中,可能有中间生成物 和________(写结构简式)生成
和________(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是________(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为________。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3
b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 图像、图表练习卷(解析版) 题型:填空题
已知甲和乙在溶液中的转化关系如图所示: 。请回答下列问题:
。请回答下列问题:
(1)若甲是10电子的阳离子,乙是碱性气体。1 mol乙通入足量强酸溶液中与H+反应,反应过程中的能量变化如图。写出乙的一种用途________________。该反应的热化学方程式为___________________________。

(2)若甲是CO2,用CO2和NH3反应可以合成尿素,合成尿素的反应分为如下两步。
第一步:2NH3(l)+CO2(g) H2NCOONH4(l)(氨基甲酸铵) ΔH1
H2NCOONH4(l)(氨基甲酸铵) ΔH1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l)(尿素) ΔH2
H2O(l)+H2NCONH2(l)(尿素) ΔH2
在一体积为0.5 L的密闭容器中投入4 mol氨和1 mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如图Ⅰ所示。

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定。
②反应进行到10 min时测得CO2的物质的量如图Ⅰ所示,则前10 min用CO2表示的第一步反应的速率为________。
③第二步反应的平衡常数K随温度的变化如图Ⅱ所示,则ΔH2________0(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 化学工艺流程练习卷(解析版) 题型:填空题
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知:Cu2O+2H+=Cu+Cu2++H2O
(1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。
(2)滤液A中铁元素的存在形式为________(填离子符号),生成该离子的离子方程式为__________________,检验滤液A中存在该离子的试剂为________(填试剂名称)。
(3)金属单质E与固体混合物F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_______________________________________________。
(4)常温下,等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍。则两种溶液的pH=________。
(5)①利用电解法进行粗铜精炼时,下列叙述正确的是________(填代号)。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.精铜作阴极,电解后电解液中Cu2+浓度减小
d.粗铜精炼时通过的电量与阴极析出铜的量无确定关系
②从浓硫酸、浓硝酸、蒸馏水中选用合适的试剂,测定粗 铜样品中金属铜的质量分数,涉及的主要步骤:称取一定质量的样品→________________→过滤、洗涤、干燥→称量剩余固体铜的质量。(填缺少的操作步骤,不必描述操作过程的细节)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
25 ℃时,在浓度均为0.01 mol·L-1的NaCN与HCN组成的混合溶液中,测得c(Na+)>c(CN-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.CN-的水解程度大于HCN的电离程度
C.c(CN-)+c(HCN)=0.02 mol·L-1
D.c(CN-)+c(OH-)=0.01 mol·L-1+c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:选择题
下图是一套电化学装置,对其有关说法错误的是( )

A.装置A是原电池,装置B是电解池
B.反应一段时间后,装置B中溶液pH增大
C.a口若消耗1 mol CH4,d口可产生4 mol气体
D.a口通入C2H6时的电极反应为C2H6-14e-+18OH- 2C
2C +12H2O
+12H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com