

| 0.672L |
| 22.4L/mol |
| 0.168L |
| 22.4L/mol |
| xg |
| 56g/mol |


科目:高中化学 来源: 题型:
| A、溶液仍然饱和,但浓度变大 |
| B、析出晶体的质量大于25克 |
| C、析出晶体的质量等于25克 |
| D、析出晶体的质量大于16克、小于25克 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、NO3-、SO42- |
| B、K+、Na+、CO32-、NO3- |
| C、K+、NH4+、MnO4-、Cl- |
| D、Mg2+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
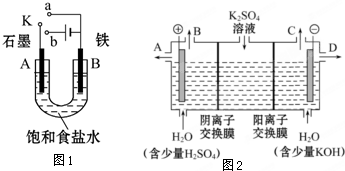 某课外活动小组用如图1装置进行实验,试回答下列问题.
某课外活动小组用如图1装置进行实验,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | ||||||
| D | E | F | |||||
| C | G | H |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com