
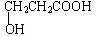 ,该物质易溶于水(填“难”或“易”),原因是能与水分子形成氢键,该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,原因是该物质分子间可形成氢键.
,该物质易溶于水(填“难”或“易”),原因是能与水分子形成氢键,该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,原因是该物质分子间可形成氢键.分析 (1)因为1 mol甲(C3H6O3)与足量钠反应生成1 mol H2,还能与NaHCO3溶液反应,则甲分子中含有1个-OH和1个-COOH,据此解答即可;依据物质含有氢键易溶于水以及有氢键会使有机物的熔沸点升高解答即可;
(2)乙与金属Na不反应,乙中不含羟基,氢的化学环境相同,说明氢原子都是等效的;因为碳、氧各有两种不同的化学环境,说明乙分子中的碳原子、氧原子有两种不同位置;类比液体油脂的密度小于水判断乙的密度与水的密度关系.
解答 解:(1)因为1 mol甲(C3H6O3)与足量钠反应生成1 mol H2,还能与NaHCO3溶液反应,则甲分子中含有1个-OH和1个-COOH,且分子中无甲基,故甲的结构简式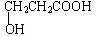 ,该物质中含有羟基和羧基,易与水形成羟基,故容易溶解与水,由于该物质自身可以生成氢键,故该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,故答案为:
,该物质中含有羟基和羧基,易与水形成羟基,故容易溶解与水,由于该物质自身可以生成氢键,故该物质的熔点明显高于相对分子质量相接近的烃类化合物的熔点,故答案为: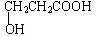 ;易;能与水分子形成氢键;该物质分子间可形成氢键;
;易;能与水分子形成氢键;该物质分子间可形成氢键;
(2)丙中不含羟基,氢的化学环境相同,说明氢原子都是等效的;因为碳、氧各有两种不同的化学环境,说明丙分子中的碳原子、氧原子有两种不同位置,其结构简式为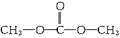 ,该物质含有官能团-COO-,故应属于酯类,液体酯类的密度一般小于水,比如油脂,相对分子质量较大,密度比水小,故
,该物质含有官能团-COO-,故应属于酯类,液体酯类的密度一般小于水,比如油脂,相对分子质量较大,密度比水小,故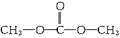 的密度小于水,故答案为:
的密度小于水,故答案为: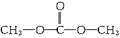 ; 酯;小.
; 酯;小.
点评 本题主要考查的是有机物结构的推断,题目综合性较强,难度中等,注意把握有机物的官能团的性质是解题的关键.


科目:高中化学 来源: 题型:多选题
| A. | 次氯酸钙溶液中通入过量二氧化碳Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 实验室制备氯气 MnO2+4H++4Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | 用氨水吸收少量二氧化硫2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| D. | Cl2通入水中Cl2+H2O?H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$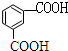
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T表示同一种核素 | |
| B. | F-离子结构示意图: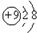 | |
| C. | 用电子式表示HCl形成过程:H${\;}_{\;}^{•}$+${\;}_{\;}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$→H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| D. | 次氯酸电子式:H${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M、N不可能在同一周期 | B. | M一定在N的下一周期 | ||
| C. | MN2肯定是共价化合物 | D. | M、N可能在同一主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛与银氨溶液水浴共热,发生还原反应得到光亮如镜的银 | |
| B. | 苯乙烯与氢气在合适条件下,发生加成反应生成乙基环己烷 | |
| C. | 乙醇与浓硫酸共热迅速升温至140℃时,发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下,发生取代反应主要生成2,4二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
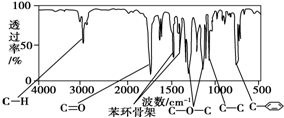 化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.
化合物A经李比希法测得其 中含C 72.0%、H 6.67%,其余含有氧;质谱法分析得知A的相对分子质量为150.现代仪器分析有机化合物的分子结构有以下两种方法.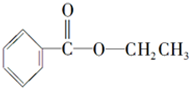 、
、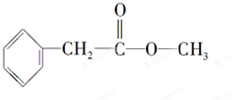 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com