
| A. | 灼烧CsCl时,火焰有特殊的颜色 | |
| B. | CsNO3易溶于水 | |
| C. | 在钠、钾、铯三种单质中,钠的熔点最低 | |
| D. | CsOH是弱碱 |
分析 A.碱金属元素的焰色反应呈现特殊的颜色;
B.依据硝酸盐都易溶于水的性质;
C.碱金属单质熔沸点从上到下依次降低;
D.碱金属金属性从上到下依次性增强,最高价氧化物对应水化物的碱性依次增强.
解答 解:A.碱金属元素的焰色反应均会呈现特殊的颜色,故A正确;
B.硝酸盐都易溶于水,所以硝酸铯易溶于水,故B正确;
C.碱金属单质熔沸点从上到下依次降低,钠、钾、铯三种单质中,钠的熔点最高,故C错误;
D.碱金属金属性从上到下依次性增强,最高价氧化物对应水化物的碱性依次增强,铯在钠、钾的下方,氢氧化钠、氢氧化钾都是强碱,所以CsOH是强碱,故D错误;
故选:CD.
点评 本题考查了碱金属的性质,明确碱金属性质的递变规律是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:简答题
研究CO2与CH4反应转化为CO和H2,对减缓燃料危机、减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890kJ·mol-1则CH4(g)+CO2(g)= 2CO(g)+2H2(g)△H=___kJ·mol-1。
(2)在密闭容器中通入物质的量浓度均为nmol的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)= 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
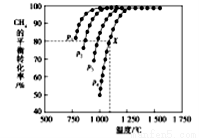
①下列事实能说明该反应一定达到平衡的是____。
a.CO2的浓度不在发生变化
b.V(CH4)=2v(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO与H2的物质的量比为1:1
②据图可知,P1、P2、P3、P4由大到小的顺序位______,理由是____。
③在压强为P4、1100℃的条件下,用n和P4列式计算X电平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压*物质的量分数)。
(3)工业上可用CO2与NH3合成制尿素的原料氨基甲酸铵(NH2COONH4)。氨基甲酸铵极易发生反应:NH2COONH4+2H2O NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
(4)控制溶液PH为9-10,用漂白粉可除去CN-、CI-废水中的CN-,CN-被氧化为两种无污染的气体,写出该反应的离子方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
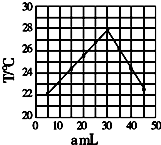 将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )| A. | 做该实验时,环境温度为22摄氏度 | |
| B. | 该实验表明化学能可能转化为热能 | |
| C. | NaOH溶液的浓度约为0.1mol/L | |
| D. | 该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在氯气中燃烧制氯化钠 | B. | 氢气和氯气混合经光照制氯化氢 | ||
| C. | 氯气通入澄清石灰水中制漂白粉 | D. | 高温分解石灰石制生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
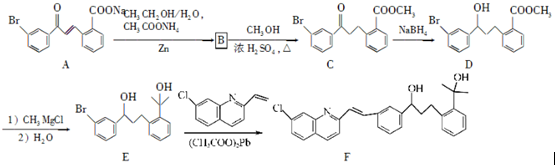 请回答下列问题:
请回答下列问题: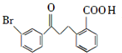 .
.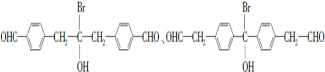 .
. 为原料制备
为原料制备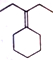 的合成路线流程图(乙醚溶剂及无机试剂任用)
的合成路线流程图(乙醚溶剂及无机试剂任用)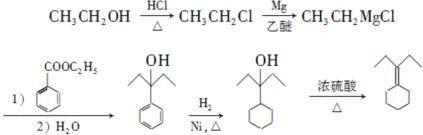 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
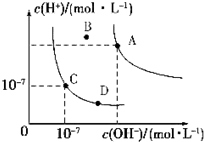
| A. | 水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) | |
| B. | B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 | |
| C. | 向水中加入醋酸钠固体,可从C点到D点 | |
| D. | 升高温度可实现由C点到D点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40 K和40 Ca原子中的质子数和中子数都相等 | |
| B. | 某元素最外层只有一个电子,则它一定是ⅠA族元素 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com