
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | —— | -3 | -2 |
下列说法正确的是( )
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Z、R的最高价氧化物的水化物之间可两两相互反应
C.R3-比Q2-更容易失去电子
D.M(OH)2的碱性比XOH的碱性强
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案科目:高中化学 来源: 题型:
关于氯化钠、氯化钙、氯化钾的下列说法正确的是( )
A.工业上利用钠与氯气反应制取氯化钠
B.向氯化钠的饱和溶液中加入少量钠无明显现象
C.氯化钙是漂白粉的有效成分
D.向氯化钠、氯化钙、氯化钾的溶液中分别加入少量硝酸银溶液,均出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学卷·2015届浙江省嘉兴市高三上学期学科基础测试(201409)】8. 下列说法正确的是
A.石油裂解的目的是为了提高汽油等轻质油的产量和质量
B.等质量的葡萄糖和淀粉燃烧消耗的氧气量相等
C.用溴水可鉴别乙醇、环已烯和甲苯
D.分别用乙烷和乙烯制备氯乙烷的反应类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
硅基太阳电池需用化合物甲作钝化材料,甲 的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g 甲与6 g H2。工业上制乙的流程如下:
的摩尔质量为140 g·mol-1,其中硅元素的质量分数为60%。已知1 molNH3与足量的化合物乙充分反应后可得到35 g 甲与6 g H2。工业上制乙的流程如下:
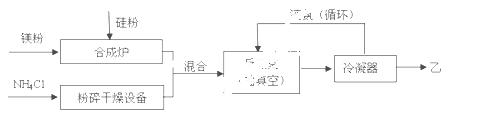
请回答下列问题:
(1)乙的电子式是 ;比较热稳定性:乙_______NH3(填>,<或=)。
(2)NH3与足量的化合物乙反应制甲的化学方程式是 。
(3)合成炉内物质需在保护气氛下高温合成,下列气体可作保护气的有 (填字母编号)。
A.O2 B.H2  C.N2 D.CO2 E.Ar
C.N2 D.CO2 E.Ar
(4)上述生产乙的过程中液氨的作用是______________________________________。
(5)甲与少量H2SO4溶液反应只得到H2SiO3和盐M两种产物,写出该反应的离子方程式 。请设计验证产物盐M的实验方案 。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究下表信息可直接得出的结论是 ( )
| 元素 | F | Cl | Br | I |
| 氢化物组成 | HF | HCl | HBr | HI |
| 氢化物形成难 易程度 | H2、F2混合,冷暗处剧烈化合并发生爆炸 | H2、Cl2混合,光照或点燃时发生爆炸 |
| H2、I2混合,加热化合,同时又分解 |
| 氢化物热稳定性 | 很稳定 | 稳定 | 较稳定 | 较不稳定 |
A.元素性 质随原子序数的递增而呈周期性变化
质随原子序数的递增而呈周期性变化
B.同周期元素的非金属性随原子序数递增而增强
C.第ⅦA族元素的金属性随电子层数增加而减弱
D.第ⅦA族元素的非金属性随电子层数增加而减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①参加反应的物质的性质是影响化学反应速率的主要因素
②光是影响某些化学反应速率的外界条件之一
③决定化学反应速率的主要因素是浓度
④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率
A.①② B.②③
C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)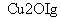
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是 ( )
A.前20 min内的反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
查看答案和解析>>
科目:高中化学 来源: 题型:
已知离子反应:Fe3++3SCN-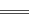 Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
Fe(SCN)3具有反应迅速、现象明显等特点,是检验Fe3+常用的方法之一。某化学兴趣小组为探究Fe(SCN)3的性质,做了以下实验:
①取10 mL l mol·L-1FeCl3溶液,滴加3~4滴浓KSCN溶液,振荡后溶液立即变成红色。
②取少量红色溶液,滴加少许浓硝酸,静置,溶液红色褪去,同时产生大量的红棕色气体混合物A。
③将该气体混合物A通入过量的Ba(OH)2溶液中,产生白色沉淀B和剩余气体C。
气体C无色无味,能使燃烧的木条熄灭,可排放到空气中,不会改变空气的成分。
④过滤,向白色沉淀B中滴加少量稀硝酸,沉淀完全溶解,同时产生能使澄清石灰水变浑浊的无色无味气体D。
⑤取②中反应后溶液少许,滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀E。
根据上述实验现象,回答下列问题:
(1)B的化学式为_________________;E的化学式为___________________。
(2)混合气体A的成分是___________________(填化学式)。
(3)该兴趣小组同学根据以上实验现象分析得出结论:Fe(SCN)3具有还原性,则实验②中反应时被氧化的元素是____________(填元素符号)。根据元素C、S、N的原子结构和共价键的相关知识推断出SCN-的结构式为_________________。
(4)实验②中反应的离子方程式为___________________________________________。
(5)该兴趣小组同学从上述实验中得到启发,若用SCN-间接检验Fe2+时应注意
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)表中原子半径最小的元素符号是 ;
(2)表中氧化性最强的单质的化学式为 ;
(3)表中最高价氧化物的水化物中碱性最强的物质的化学式是 ,酸性最强的物质的化学式是________________________________;
(4)④⑤⑥三种元素中,离子半径大小的顺序为 > >
(填离子符号);
(5)③⑦⑧三种元素的气态氢化物的稳定性强弱顺序为 >
> (填化学式);
(6)元素②的氢化物与元素⑧的氢化物反应的化学方程式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com