
Na2SO3、SO2是中学常见的物质。
(1)某同学用下图示装置制取干燥纯净的SO2。

写出制取SO2气体的化学方程式 。请指出D装置中的错误 。若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是 。
(2)向烧碱和Na2SO3的混合溶液中加入少量溴水,振荡后溶液变为无色。反应后的溶液中含有大量的SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO32-、SO42-和Br-的实验报告。限选试剂:2 mol/LHCl,1 mol/L H2SO4,l mol/LBaCl2,l mol/LBa(NO3)2,0.1 mol/LAgNO3,CCl4,新制饱和溴水,新制饱和氯水。
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤① |
在试管A中加入少量待测液,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色。 |
,证明待测液中含Br-。 |
|
步骤② |
在试管B中加入少量待测液,
|
有白色沉淀生成, 证明待测液中含SO42-。 |
|
步骤③ |
在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴______(填试剂),振荡。 |
, 证明待测液中含SO32-。 |
(1)Cu + 2H2SO4  CuSO4
+ SO2↑+ 2H2O(2分) 进气管比出气管短(2分)
CuSO4
+ SO2↑+ 2H2O(2分) 进气管比出气管短(2分)
立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液 (2分)
(2)
|
编号 |
实验操作 |
预期现象和结论 |
|
步骤① |
|
溶液分层,下层呈橙红色(2分) |
|
步骤② |
加入过量的2mol/L盐酸,再滴加1mol/L BaCl2溶液(2分) |
|
|
步骤③ |
新制饱和溴水(2分) |
溴水褪色(2分) |
【解析】
试题分析:(1)根据题给装置图分析,制取SO2气体的原理是铜和浓硫酸共热生成硫酸铜、二氧化硫和水,化学方程式为Cu + 2H2SO4  CuSO4
+ SO2↑+ 2H2O;D装置为二氧化硫的收集装置,二氧化硫的密度比空气大,应用向上排空气法收集,装置中的错误是进气管比出气管短;若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;(2)鉴定混合液中的SO32-、SO42-和Br-离子,根据题给试剂设计实验方案。①取少量待测液于试管A中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,②取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;③在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴新制溴水,振荡,新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-。
CuSO4
+ SO2↑+ 2H2O;D装置为二氧化硫的收集装置,二氧化硫的密度比空气大,应用向上排空气法收集,装置中的错误是进气管比出气管短;若实验过程中不慎在皮肤上沾少量浓硫酸,处理的方法是立即用大量水冲洗,再涂上3%~5%的NaHCO3溶液;(2)鉴定混合液中的SO32-、SO42-和Br-离子,根据题给试剂设计实验方案。①取少量待测液于试管A中,加入足量氯水,再加入四氯化碳,振荡,静置后观察颜色,溴溶解在四氯化碳中,下层为橙红色,说明含Br-,②取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液,观察到白色沉淀的生成,说明含SO42-;③在试管C中加入少量待测液,滴加2 mol/LHCl至溶液呈酸性,加入几滴新制溴水,振荡,新制饱和溴水与亚硫酸根离子的氧化还原反应,观察溴水褪色,说明含SO32-。
考点:考查二氧化硫的实验室制备及离子检验。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| △ |
| ||
| △ |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
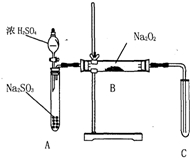 化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了右图所示的装置进行实验(已知制取SO2的反应为H2SO4+Na2SO3=Na2SO4+SO2↑+H2O)充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:
化学兴趣小组同学运用类比学习的思想,探究过氧化钠与二氧化硫的反应.小组同学改进了右图所示的装置进行实验(已知制取SO2的反应为H2SO4+Na2SO3=Na2SO4+SO2↑+H2O)充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.试回答下列问题:| 实验操作 | 预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com