
| A、甲烧杯产生的氢气比乙烧杯少 |
| B、乙烧杯中的酸一定过量 |
| C、两烧杯中参加反应的锌等量 |
| D、反应开始时乙烧杯中产生氢气的速率比甲烧杯快 |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
| A、核电荷数 | B、核外电子数 |
| C、电子层数 | D、原子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012 kg碳 |
| B、含有6.02×1023个粒子的物质 |
| C、含有阿伏加德罗常数个粒子的物质 |
| D、含有与6.02×1023个碳原子等质量的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
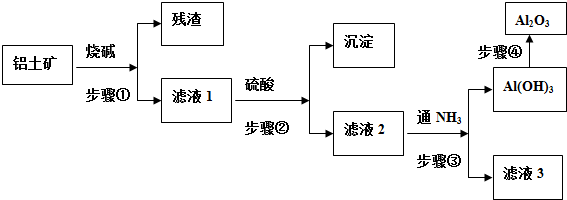
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、Cl-、NO3- |
| B、Mg2+、Ca2+、SO42-、OH- |
| C、Fe2+、Fe3+、H+、NO3- |
| D、Ba2+、Fe3+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 120℃ | 300℃ | 480℃ | |
| 化学式 | KxFey(C2O4)Z | KxFeyO(C2O4)Z-1 | KxFeyO2(C2O4)Z-2 |
| 质量 | 4.370g | 3.650g | 2.930g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com