
 $→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐
$→_{④}^{Na_{2}CO_{3}}$$→_{⑤}^{()}$滤液$→_{⑥}^{适量盐酸}$$→_{⑦}^{蒸发、结晶、烘干}$精盐 中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.
中填写所使用除杂试剂的化学式NaOH,在⑤中的操作名称是过滤.分析 由流程可知,①溶解,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,⑤过滤,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶⑦烘干得到NaCl.
(1)钡离子除去硫酸根离子,钡离子过量,再加氯化钡不会生成沉淀;
(2)加入过量的Na2CO3去除钙离子的多余的钡离子,形成碳酸钡、碳酸钙沉淀;
(3)③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,得到氢氧化镁、碳酸钙、碳酸钡沉淀,通过⑤过滤,达到固液分离;
(4)除去钙离子用碳酸钠、除去镁离子用氢氧化钠、除去硫酸根离子用氯化钡,过滤后用盐酸除去过量的氢氧根离子、碳酸根离子,碳酸钠必须放在氯化钡溶液之后,据此判断;
(5)碳酸钡、碳酸钙、氢氧化镁溶于盐酸,先用盐酸再进行操作⑤,影响制得精盐的纯度.
解答 解:(1)BaCl2已过量,则再加氯化钡不会生成沉淀,则实验方法为用试管取少量第②步操作后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可),
故答案为:取第②步后的上层清液1~2滴于点滴板上(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(合理答案皆可);
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,反应的实质是:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;Ba2++CO32-=BaCO3↓;
(3)由流程可知,①溶解,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子Mg2++2OH-=Mg(OH)2↓,④中加碳酸钠可除去钡离子、钙离子,⑤过滤,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶⑦烘干得到NaCl,
故答案为:NaOH ⑤过滤;
(4)除去粗盐中的可溶性杂质:Ca2+、Mg2+、SO42-时,可以加入过量NaOH(去除镁离子):Mg2++2OH-=Mg(OH)2↓,加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3↓,最后加适量盐酸,盐酸与过量NaOH溶液和过量Na2CO3溶液发生反应,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑,从而除掉过量的OH-、CO32-;碳酸钠必须加在氯化钡之后,否则过量的钡离子无法除去,所以步骤②和④不可以颠倒,至于先除镁离子、还是先除钙离子,无先后,所以步骤③和④可颠倒,
故答案为:否;过量的BaCl2必须要用Na2CO3除去,步骤复杂; 是;
(5)⑤过滤除掉碳酸钡、碳酸钙、氢氧化镁、硫酸钡沉淀,过滤后主要为氯化钠和碳酸钠,若先用盐酸再进行操作⑤,碳酸钡、碳酸钙、氢氧化镁溶于盐酸,从而影响制得精盐的纯度,
故答案为:会有部分沉淀溶解,从而影响制得精盐的纯度.
点评 本题主要考查了粗盐提纯实验,为高频考查点,侧重于学生的分析和实验能力的考查,综合性强,要注意除杂质选取和添加的先后顺序,注意相关基础知识的积累,题目难度中等.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LH2O含有的分子数为0.5NA | |
| B. | 在常温常压下,11.2LCl2含有的分子数为0.5NA | |
| C. | 25℃,1标准大气压下,64g SO2 中含有的原子数为3NA | |
| D. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
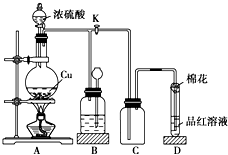 某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:
某化学兴趣小组为探究铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
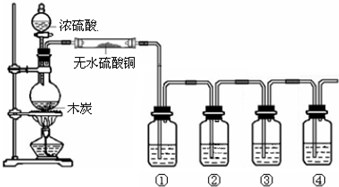
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
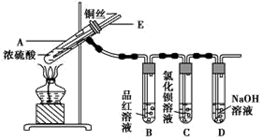
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
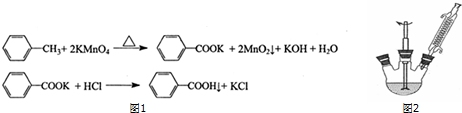
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易烯易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃2.7g | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
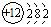 ,O2-结构示意图:
,O2-结构示意图: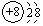 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com