
| △c |
| △t |
| 0.7mol |
| 2L |
| ||
| 3min |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
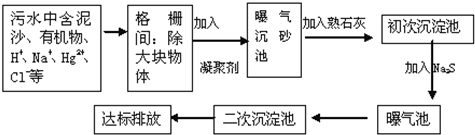
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.
A、B、C、D、E、F六种元素位于周期表前四周期且原子序数依次增大.①A元素的一种核素中子数是质子数的2倍;②基态B原子核外有两个未成对电子;③大气中C的游离态含量最高;④D原子基态核外电子运动状态共8种;⑤E、F原子序数相差3,基态E原子中有4个未成对屯子且全在同一能级内.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、④⑤⑥⑧ |
| C、除④⑧外 | D、⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | M | R |
| A、气态氢化物稳定性:X>Y |
| B、最高价氧化物的水化物的酸性:Y>M |
| C、Z单质是一种常用的半导体材料 |
| D、Z、M、R的原子半径依次增大,最高化合价依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇(水) 加新制的生石灰,过滤 |
| B、乙烷(乙烯) 通过溴的四氯化碳溶液,洗气 |
| C、溴苯(苯) 加水,振荡静置后分液 |
| D、乙酸乙酯(乙酸) 加饱和NaHCO3溶液,振荡静置后分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com