
下表中所列的字母分别代表某一化学元素。完成下列填空:
|
a |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
b |
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
d |
|
|
e |
f |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
|
|
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)h的最外层有____种运动状态的电子。a、b、c三种元素形成的化合物电子式为________。
(2)d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为____________。
(3) 元素e与f元素相比,非金属性较强的是__________(写元素符号),下列表述中能证明这一事实的是__________(选填序号)。
a. e的阴离子还原性强于f的阴离子 b. f的氢化物酸性强于e的氢化物
c. e单质的熔点高于f单质 d. e和f形成的化合物中,e显正价,f显负价
(4)元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置_______________________________。
(本题共8分)(1)6(1分),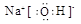 (1分);
(1分);
(2)2Al+2OH—+2H2O→2AlO2—+3H2↑(2分);
(3)Cl(1分),ad(2分);
(4)第四周期VA族(1分)
【解析】
试题分析:(1)根据元素在周期表中的相对位置可知,h是第五周期第ⅥA族的Te,根据构造原理可知其核外电子排布式是1s22s22p63s23p63d104s24p64d105s25p4,所以h的最外层有6种运动状态的电子。a、b、c三种元素分别是H、O、Na,三种元素形成的化合物是氢氧化钠,氢氧化钠是离子化合物,其电子式为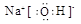 。
。
(2)d是铝,i是Ba,氢氧化钡是强碱能溶解金属铝,反应的离子方程式是2Al+2OH—+2H2O→2AlO2—+3H2↑。
(3)元素e与f元素分别是S和Cl,同周期自左向右非金属性逐渐增强,所以氯元素的非金属性强于硫元素的非金属性。a.非金属性越强,相应阴离子的还原性越弱,所以根据e的阴离子还原性强于f的阴离子可以说明氯元素的非金属性强于硫元素的,a正确;b.氢化物的酸性强弱与非金属性强弱无关系,因此f的氢化物酸性强于e的氢化物不能说明氯元素的非金属性强于硫元素的,b不正确;c. 非金属单质的熔点与非金属性强弱无关系,则根据e单质的熔点高于f单质 不能说明氯元素的非金属性强于硫元素的,c不正确;d.非金属性越强,越容易得到电子,因此根据e和f形成的化合物中,e显正价,f显负价可以说明氯元素的非金属性强于硫元素的,d正确,答案选ad。
(4)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以所在周期原子半径最大的非金属元素,其气态氢化物为三角锥形极性分子的元素应该是第四正确第ⅤA族的As元素。
考点:考查元素周期表的结构、元素周期律以及核外电子排布、电子式和方程式书写等


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
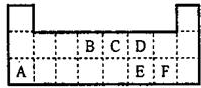 如图为元素周期表的一部分.表中所列的字母分别代表某一元素.
如图为元素周期表的一部分.表中所列的字母分别代表某一元素.
查看答案和解析>>
科目:高中化学 来源:训练必修二化学鲁科版 鲁科版 题型:022
下表是元素周期表的一部分,下表中所列的字母分别代表某一化学元素.

(1)下列________(填写编号)组元素的单质可能都是电的良导体.
①a、c、h
②b、g、k
③c、h、l
④d、e、f
(2)如果给核外电子足够的能量,这些电子便会脱离原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
a.原子核对核外电子的吸引力
b.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
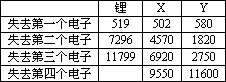
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个原子所需的能量?________
②表中X可能为以上13种元素中的________(填写字母)元素.用元素符号表示X和j形成化合物的化学式________.
③Y是周期表中的________族元素.
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多.
查看答案和解析>>
科目:高中化学 来源:上海市虹口区2013年高考一模化学试题 题型:022
下表中所列的字母分别代表某一化学元素.完成下列填空∶
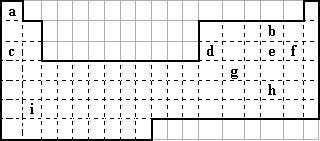
1.h的最外层有________种运动状态的电子.a、b、c三种元素形成的化合物电子式为________.
2.d单质溶于i的最高价氧化物对应水化物的溶液时发生反应的离子方程式为________.
3.元素e与f元素相比,非金属性较强的是________(写元素符号),下列表述中能证明这一事实的是________(选填序号).
a.e的阴离子还原性强于f的阴离子
b.f的氢化物酸性强于e的氢化物
c.e单质的熔点高于f单质
d.e和f形成的化合物中,e显正价,f显负价
4.元素X(非a~i元素)是所在周期原子半径最大的非金属元素,它的气态氢化物为三角锥形极性分子,写出X在周期表中的位置________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com