
| A、H2O | B、KHSO4 | C、Na3PO4 | D、NaHCO3 |
科目:高中化学 来源: 题型:
| A、CH2═CH2 | B、CH3CH═CH2 | C、CH3CH3 | D、CH2═CHCH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
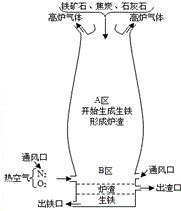 钢铁工业是国家工业的基础.下图是炼铁高炉及炉内化学变化过程示意图,根据图示回答下列问题.若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式.
钢铁工业是国家工业的基础.下图是炼铁高炉及炉内化学变化过程示意图,根据图示回答下列问题.若图中采用的铁矿石的主要成分为氧化铁,请写出A区和B区所发生主要反应的化学方程式.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾既可以除去水中的悬浮物,也可以杀菌消毒 | B、可以通过电解明矾溶液来制取Al | C、用酒精灯加热铝箔至熔化,铝并不滴落,说明氧化铝的熔点比铝高 | D、可以用在某溶液中加入盐酸酸化的氯化钡溶液的方法来确定该溶液中是否含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打可与酸反应,可用作治疗胃酸过多的药剂 | B、氯化铝是电解质,可电解其水溶液获得金属铝 | C、SO2具有漂白性,可用于将银耳漂白为“雪耳” | D、二氧化硅具有导电性,可用于生产光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池板中有高纯硅单质,光导纤维的主要成分也是硅 | B、分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | C、核磁共振谱、红外光谱、紫外光谱和质谱法的综合运用,可用于分析有机物的结构 | D、绿色荧光蛋白在研究癌症发病机制的过程中应用突出,在酸性或碱性条件下可能会失去发光功能 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:填空题
(16分)已知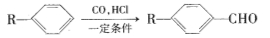
为合成某种液晶材料的中间体M,有人提出如下不同的合成路径:
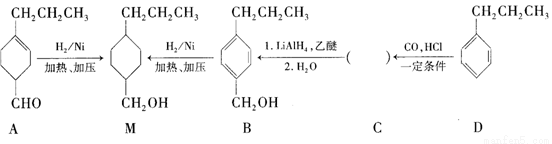
(1)常温下,下列物质能与A发生反应的有________(填序号)。
a.苯 b.Br2/CCl4c.乙酸乙酯d.KMnO4/H+溶液
(2)M中官能团的名称是_______,由C→B的反应类型为__________。
(3)由A催化加氢生成M的过程中,可能有中间产物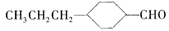 和______(写结构简式)生成。
和______(写结构简式)生成。
(4)检验B中是否含有C可选用的试剂是___________(任写一种名称)。
(5)物质B也可以由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为_______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
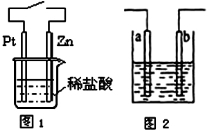
A.与铜质水龙头连接处的钢质水管不易发生腐蚀
B.用电解法提取氯化铜废液中的铜,可以用碳棒连接电源的正极,另一电极用铜片
C.图1中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图2所示装置可发生反应的离子方程式为Zn + 2H+=Zn2++ H2↑,且a、b电极不可能是同种材料
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:填空题
(16分)Ⅰ.已知下列反应的热化学方程式为:
C(s) + O2(g) CO2(g) ΔH1 = -393.5 kJ/mol
CO2(g) ΔH1 = -393.5 kJ/mol
CH3COOH(l) + 2O2(g) 2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2CO2(g) + 2H2O(l) ΔH 2 = -870.3 kJ/mol
2H2(g) + O2(g) 2H2O(l) ΔH 3 = -571.6 kJ/mol
2H2O(l) ΔH 3 = -571.6 kJ/mol
请计算2C(s) + 2H2(g) + O2(g) CH3COOH(l) ΔH 4 = 。
CH3COOH(l) ΔH 4 = 。
Ⅱ.在某温度下,物质(t-BuNO)2在正庚烷或CCl4溶剂中均可以发生反应:
(t-BuNO)2 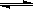 2(t-BuNO)
2(t-BuNO)
该温度下该反应在CCl4溶剂中的平衡常数为1.4 mol/L。
(1)向1 L正庚烷中加入0.50 mol (t-BuNO)2,10 min时反应达平衡,此时(t-BuNO)2的平衡转化率为60%(假设反应过程中溶液体积始终为1 L)。反应在前10 min内的平均速率为v(t-BuNO)= 。计算上述反应的平衡常数K。(写出计算过程,计算结果保留3位有效数字)
(2)有关反应:(t-BuNO)2 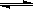 2(t-BuNO) 的叙述正确的是________
2(t-BuNO) 的叙述正确的是________
A.压强越大,反应物的转化率越大 B.温度升高,该平衡一定向右移动
C.溶剂不同,平衡常数K值不同
(3)通过比色分析得到40℃时(t-BuNO)2和(t-BuNO)浓度随时间的变化关系的几组数据如下表所示,请在同一图中绘出(t-BuNO)2和(t-BuNO)浓度随时间的变化曲线。
时间(min) | 0 | 1 | 3 | 5 | 7 | 9 | 11 |
c(t-BuNO)2 mol/L | 0.05 | 0.03 | 0.01 | 0.005 | 0.003 | 0.002 | 0.002 |
c(t-BuNO) mol/L | 0 | 0.04 | 0.08 | 0.09 | 0.094 | 0.096 | 0.096 |

Ⅲ.甲醇燃料电池的电解质溶液是KOH溶液。则通入甲醇的电极反应式为 。若通空气的电极上有32g O2参加反应,则反应过程中转移了______ mol e-。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com