
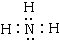 .
.分析 常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-;“A可电离生成D和F“,则F为H3O+;再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,据此进行解答.
解答 解:常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-;“A可电离生成D和F“,则F为H3O+;再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,
(1)根据分析可知,B为NH3,NH3为共价化合物,其电子式为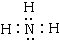 ,
,
故答案为: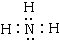 ;
;
(2)A为H2O、B为NH3,E为Mg2+或Al3+,A、B、E三种微粒反应的离子方程式为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+,
故答案为:Al3++3NH3+3H2O═Al(OH)3↓+3NH4+或Mg2++2NH3+2H2O═Mg(OH)2↓+2NH4+;
(3)上述五种粒子中,氨气能够与水合氢离子反应生成铵根离子和水:NH3+H3O+=NH4++H2O,氢氧根离子可以与水合氢离子反应生成水:OH-+H3O+=2H2O,铵根离子可以与氢氧根离子反应生成氨气和水:NH4++OH-=NH3↑+H2O,
故答案为:NH3+H3O+=NH4++H2O(或OH-+H3O+=2H2O、NH4++OH-=NH3↑+H2O);
(4)A、B、D分别为H2O、NH3、OH-,碱性越强,结合质子能力越强,则粒子结合质子(H+)的能力由强到弱的顺序是:OH->NH3>H2O,
故答案为:OH->NH3>H2O.
点评 本题考查无机物的推断、离子反应等,题目难度中等,掌握常见的10电子微粒及其性质是推断的关键,B溶于A后所得的物质可电离出C和D为解答的突破口,试题培养了学生的分析能力及逻辑推理能力.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(1s) | C. | E(4f)>E(4s)>E(3d) | D. | E(5s)>E(4s)>E(4f) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
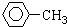 $\stackrel{KMnO_{4}}{→}$
$\stackrel{KMnO_{4}}{→}$ 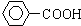
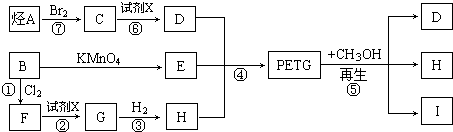
 I:
I: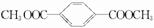 .
.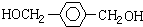 +3H2$→_{△}^{催化剂}$
+3H2$→_{△}^{催化剂}$ ;反应⑥CH2Br-CH2Br+2H2O$→_{△}^{NaOH}$CH2OH-CH2OH+2HBr.
;反应⑥CH2Br-CH2Br+2H2O$→_{△}^{NaOH}$CH2OH-CH2OH+2HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
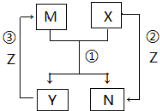 X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )
X、Y、Z是中学常见的三种单质,M、N是中学常见的两种化合物,其中M在常温下为液态,它们之间存在如图转化关系.下列说法错误的是( )| A. | 该过程所涉及的反应均为氧化还原反应 | |
| B. | 当X单质为金属时,可能是Na或Fe | |
| C. | 当X单质为非金属时,X可以是 碳 | |
| D. | 反应①一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙炔中混有的H2S气体通过盛有氢氧化钠溶液的洗气瓶 | |
| B. | 除去甲烷中混有的乙烯通过盛酸性高锰酸钾溶液的洗气瓶 | |
| C. | 除去酒精中的水加入足量生石灰后进行蒸馏 | |
| D. | 除去苯中混有的苯酚加入足量氢氧化钠溶液后进行分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第1列和第2列元素都是金属元素 | |
| B. | 只有第2列元素原子的最外层是2个电子 | |
| C. | 第16列和第17列元素都只能以化合态存在于自然界中 | |
| D. | 第17列元素的单质熔、沸点逐渐升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com