
若要在铜片上镀银时,下列叙述中错误的是()
①将铜片接在电源的正极②将银片接在电源的正极③在铜片上发生的反应是:Ag++e﹣═Ag④在银片上发生的反应是:4OH﹣﹣4e﹣═O2+2H2O⑤可用CuSO4溶液作电解质溶液⑥可用AgNO3溶液作电解质溶液.
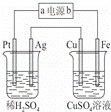
A. ①③⑥ B. ②③⑥ C. ①④⑤ D. ②③④⑥
考点: 电解原理.
专题: 电化学专题.
分析: 若在铜片上镀银时,铜做电解池的阴极与电源负极相连,电解质溶液中的银离子得到电子发生还原反应生成银;银做电解池的阳极和电源正极相连,铜失电子发生氧化反应生成铜离子;电解质溶液为硝酸银溶液;
解答: 解:阳极电镀原理,若在铜片上镀银时,铜做电解池的阴极与电源负极相连,电解质溶液中的银离子得到电子发生还原反应生成银;银做电解池的阳极和电源正极相连,铜失电子发生氧化反应生成铜离子;电解质溶液为硝酸银溶液;
①将铜片应接在电源的负极上,故①错误;
②将银片应接在电源的正极上,故②正确;
③在铜片上发生的反应是:2Ag++2e﹣=2Ag 故③正确;
④在银片上发生的反应是:2Ag++2e﹣=2Ag,故④错误;
⑤用硫酸铜溶液为电镀液,阴极析出铜,故⑤错误;
⑥需用硝酸银溶液为电镀液.故⑥正确;
综上所述①④⑤错误;
故选C.
点评: 本题考查了电解原理的应用,电镀池的工作原理分析,电极判断、电解名称、电极反应,题目较简单.


科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol•L﹣1.
(2)取用任意体积的该盐酸溶液时,下列物理量中,不随取用的体积多少而变化的是 .
A.HCl的摩尔质量 B.溶液的浓度
C.溶液中Cl﹣的质量分数 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.4mol•L﹣1的稀盐酸.
①该学生需选择容量瓶的规格为 mL;(填:100、250、500、1000)
该学生需要量取 ml 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
Ⅰ.用量筒量取浓盐酸时,俯视观察凹液面
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(填:“偏大”、“偏小”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
某炔烃X加氢后,得CH3CH2CH(CH3)CH3,则X是()
A. 2﹣甲基﹣1﹣丁炔 B. 3﹣甲基﹣1﹣丁炔
C. 2﹣甲基﹣2﹣丁炔 D. 1﹣戊炔
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在容积固定不变的密闭容器中加入一定量的X和Y进行如下可逆反应,2X(g)+Y(s)⇌Z(g)+W(g)△H>0,一段时间后达到化学平衡状态后,再改变某一条件,下列有关叙述正确的是()
A. 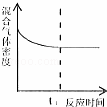
t1时刻表示该可逆反应达到新的平衡
B. 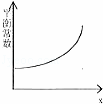
横坐标x可表示温度或容器的体积
C. 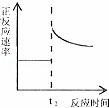
t2时刻改变的体积为加入少量的Y
D. 
横坐标可表示为Z的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 A B C D E F
混
合
溶
液 4mol/LH2SO4/mL 30 V1 V2 V3 V4 V5
饱和CuSO4/mL 0 0.5 2.5 5 V6 20
H2O/mL V7 V8 V9 V10 10 0
时间(min) 15 10 5 3 6 9
①请完成此实验设计,其中:V1= ,V6= ,V9= ;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因 ;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2: .
(4)请你设计实验验证上述假设1,完成下表内容.
实验方案(不要求写具体操作过程) 预期实验结果和结论
,
查看答案和解析>>
科目:高中化学 来源: 题型:
在一支注射器中,装有NO2和N2O4(无色)的混合气体,它们的相互转化关系为:2NO2(g)⇌N2O4(g).在达到平衡状态后,如果慢慢压缩气体使体积变为原来的二分之一,此时混合气体的颜色与原来相比()
A. 由红棕色变为无色 B. 变浅
C. 由无色变为红棕色 D. 变深
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H2⇌2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示.下列关系中能说明反应已达到平衡状态的是()
A. 3v正(N2)=v正(H2) B. v正(N2)=v正(NH3)
C. v正(H2)=3v逆(NH3) D. 3v正(N2)=v逆(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是()
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体.
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应的离子方程式正确的是()
A. 氢氧化镁中滴加盐酸:H++OH﹣═H2O
B. 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+
C. 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:H++SO42﹣+Ba2++OH﹣═BaSO4↓+H2O
D. NH4HCO3溶液中加入过量NaOH溶液并加热:NH4++HCO3﹣+2OH﹣ NH3Ÿ+CO32﹣+2H2O
NH3Ÿ+CO32﹣+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com