
| A. | 元素周期表共7个横行,包含4个短周期和3个长周期 | |
| B. | 元素周期表共16个纵行,包含7个主族、7个副族、1个第Ⅷ族、1个零族 | |
| C. | 第五周期第ⅡA元素与第ⅢA元素原子序数相差11 | |
| D. | 第ⅣA族相邻元素原子序数之差可能为2、8、18、32 |
分析 A、元素周期表共7个横行,7个周期,包含3个短周期和4个长周期;
B、元素周期表共18个纵行,16个族,包含7个主族、7个副族、1个第Ⅷ族、1个零族;
C、第ⅡA族与第ⅢA族的元素,短周期相差1、4和5周期相差11、6和7周期相差25;
D、一至七周期元素的种类数为2、8、8、18、18、32、26;
解答 解:A、元素周期表共7个横行,7个周期,包含3个短周期和4个长周期,故A错误;
B、元素周期表共18个纵行,16个族,包含7个主族、7个副族、1个第Ⅷ族、1个零族,故B错误;
C.第ⅡA族与第ⅢA族的元素,原子序数之差在短周期相差1(相邻)、4和5周期相差11(中间为副族和第ⅤⅢ族)、6和7周期相差25(中间为副族和第ⅤⅢ族且含锕系和镧系),所以第五周期第ⅡA元素与第ⅢA元素原子序数相差11,故C正确;
D、一至七周期元素的种类数为2、8、8、18、18、32、26,则同主族相邻元素原子序数之差可以是2、8、18、32,而第ⅣA族相邻元素原子序数之差不可能为2,故D错误;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素在周期表的位置、元素的性质及元素周期律为解答的关键,注意整体把握周期表的结构,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ③①⑥⑦②④⑤ | B. | ⑥①②⑦③④⑤ | C. | ⑤④③①⑥⑦② | D. | ⑥③⑦①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 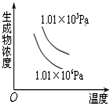 4NH3(g)+5O2(g)?4NO+6H2O(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 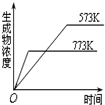 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. |  N2(g)+3H2(g)?2NH3(g);△H=-Q3kJ/mol(Q3>0) | |
| D. | 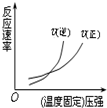 H2(g)+CO(g)?C(s)+H2O(g);△H=+Q4kJ/mol(Q4>0) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应.
短周期元素a、b、c、d的原子序数依次增大.它们分属于不同主族,这四种元素的原子电子层数之和为8.A、B、C、D依次为a、b、c、d的单质,甲、乙、丙分子内原子数依次为4、3、2.在一定条件下可以发生如图所示的化合反应. ,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.
,若将甲通入乙中所得溶液PH大于7,用方程式表示溶液PH大于7 的原因:NH3•H2O?NH4++OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有A、B、C、D、E五种元素,其相关信息如表:
有A、B、C、D、E五种元素,其相关信息如表:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层 上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑤⑥⑦ | B. | ②③④⑤ | C. | ①②④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅燃烧产物对环境产生的污染,容易得到有效控制 | |
| B. | 硅燃烧可以放出较多的热量 | |
| C. | 自然界中硅的贮存量丰富,可以从自然界直接获得单质硅 | |
| D. | 硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com