
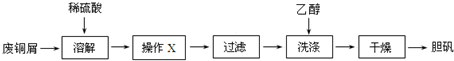
���� ��1��ͭ��ϡ�����Ӧ����Ҫ�ṩ�����Խ�ǿ����������Ϊ���������ʣ���ͨ�������������
��2��������ͭ��Һ�Ʊ����壬������Ũ������ȴ�ᾧ��Ϊ��ȥ�������Ŀ������������ӣ���Ծ���ϴ�ӣ���ˮϴ�ӻ�ʹ���岿���ܽ���ˮ�У����л��ܼ��Ҵ�ϴ�ӿɼ��پ�����ܽ⣬������ɹ�����ʧ��
��3��ͭм�к���0.1mol����ͭ��0.5molͭ�����ݷ�ӦCuO+H2SO4=CuSO4+H2O��3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O�ɼ��㣬�����
��� �⣺��1��ͭ��ϡ�����Ӧ����Ҫ�ṩ�����Խ�ǿ����������Ϊ���������ʣ���ͨ��������������ʴ�Ϊ������������������
��2��������ͭ��Һ�Ʊ����壬�����Һ���м��ȣ�����Ũ������ȴ�ᾧ��Ϊ��ȥ�������Ŀ������������ӣ���Ծ���ϴ�ӣ���ˮϴ�ӻ�ʹ���岿���ܽ���ˮ�У����л��ܼ��Ҵ�ϴ�ӿɼ��پ�����ܽ⣬������ɹ�����ʧ���ʴ�Ϊ������Ũ������ȴ�ᾧ ��������ͭ�����ܽ⣻
��3���ٸ���n��CuO��=��40��20%����80=0.1mol
n��Cu��=��40-40��20%����64=0.5mol
CuO+H2SO4=CuSO4+H2O
0.1mol 0.1mol
3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O
0.5mol 0.5mol
n��CuSO4��=0.1+0.5=0.6mol
��CuSO4-CuSO4•5H2O֪��n��CuSO4•5H2O��=n��CuSO4��=0.6mol��m��CuSO4•5H2O��=0.6��250=150g
�ʴ�Ϊ��150g��
��n��CuO��=��40��20%����80=0.1mol
n��Cu��=��40-40��20%����64=0.5mol
3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O
�� n��HNO3��=0.5��2��3=1/3mol
n��H2SO4��=0.5mol
������ͭ��Ӧ���������Ϊn��H2SO4��=n��CuO��=0.1mol
n��H2SO4����n��HNO3��=��0.5+0.1����1/3=9��5
�ʴ�Ϊ��9��5��
���� ���⿼�������ʵ������ڻ�ѧ����ʽ�ļ��㡢ʵ��ԭ���ķ����ȣ���Ŀ�Ѷ��еȣ������ڿ���ѧ����ʵ��̽�������ͼ���������


 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��֤����ת�� | B�� |  ��ȥ���еı��� | ||
| C�� |  �۲�����������ʴ | D�� |  ������Ȳ�Ļ�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | B�ĵ�������Ȼ��ֻ��һ�ֺ��� | |
| B�� | Ԫ��C��D��E�ļ����ӵİ뾶���μ�С | |
| C�� | E�ĵ�����������ǿ | |
| D�� | ������AE��CE������ͬ���͵Ļ�ѧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| Fe | H2O��g�� | Fe3O4 | H2 | |
| ��ʼ/mol | 3.0 | 4.0 | 0 | 0 |
| ƽ��/mol | m | n | p | q |
| Fe | H2O��g�� | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C2H6 | B�� | C4H6 | C�� | C5H10 | D�� | C6H12O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
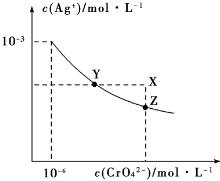
| A�� | �� t��ʱ��AgCl ���ܽ�ȴ��� Ag2CrO4 | |
| B�� | �� t��ʱ��Ag2CrO4�� Ksp=1��10-1210-3 | |
| C�� | �ڱ��� Ag2CrO4��Һ�м���K2CrO4����ʹ��Һ��Y�㵽X �� | |
| D�� | �� t��ʱ���� AgNO3 ����Һ�ζ� 20mL δ֪Ũ�ȵ� KCl ��Һ�����ܲ���K2CrO4��ҺΪָʾ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ��ͼ��ʾ����п�̵���У������缫��ӦΪZn-2e-�TZn2+ | |
| B�� | 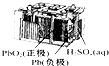 ��ͼ��ʾǦ���طŵ�����У�����Ũ�Ȳ������� | |
| C�� | 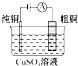 ��ͼ��ʾ��⾫��ͭװ�ù��������У��������Һ��Cu2+Ũ��ʼ�ղ��� | |
| D�� | 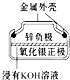 ��ͼ��ʾ��пŦ�۵���У�Ag2O������������ع��������б���ԭΪAg |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������в���H7N9ʱ�в������棬��������ǿ��Ҫ��������Ӵ����ݣ�����ҲӦ��ǿ����Ԥ������������������ѡ�ú������������ƾ���˫��ˮ�����˵����� | |
| B�� | �����ݹ����������Һ�Ĺ������������ʵ�ˮ��������Ϊ�˴���ˮ�� | |
| C�� | ���������������ڳ����½��ȶ����������еȶȵֿ�����56�治����ȫ��60��30min�����ƻ����Ⱦ�ԣ��˹�����Ҫ�����˵����ʵı��� | |
| D�� | �ö�����̼��ȫ�������ϣ����Ի�������ЧӦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʯī�������Ƚ��ʯ�� | B�� | ʯī�ͽ��ʯ����̼��ͬλ�� | ||
| C�� | ���ʯת��Ϊʯī�������仯 | D�� | ���ʯ��ʯī���ȶ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com