
【题目】有如下转化关系(其他产物及反应所需条件均已略去)。
![]()
以下推断错误的是
A.当X是盐酸时,则F可能是稀硫酸
B.当X是氢氧化钠时,则D是红棕色气体
C.当X是不论是盐酸还是氢氧化钠时,则F都可能是强酸
D.当X是氢氧化钠时,B跟Cl2反应可能有白烟现象
【答案】B
【解析】
A选项,A为硫化钠与盐酸反应生成硫化氢,硫化氢和氯气反应生成硫单质,硫与氧气反应生成二氧化硫,二氧化硫与氧气反应生成三氧化硫,三氧化硫和水反应生成硫酸,故A正确;
B选项,A为氯化铵时,X是氢氧化钠,氯化铵与NaOH反应生成氨气,氨气与氯气反应生成氯化铵和氮气,氮气和氧气放电生成一氧化氮(无色气体),一氧化氮与氧气反应生成二氧化氮,二氧化氮和水反应生成硝酸,故B错误;
C选项,根据AB得出,当X是不论是盐酸还是氢氧化钠时,则F都可能是强酸,故C正确;
D选项,根据B选项分析,当X是氢氧化钠时,氨气跟Cl2反应可能生成氯化铵,有白烟现象,故D正确;
综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】盐酸和醋酸是生产、生活和化学实验中常见的酸。请回答:
(1)人的胃液中含有盐酸,经测定某人胃液的pH为2.0,则其中的c(H+)=___moL。
(2)食醋常用于食品调味,其主要成分为醋酸。醋酸的电离方程式为____。
(3)室温下,pH均为3的盐酸和醋酸溶液,下列各项中相等的是__(填编号)。
①溶液中的c(H+) ②酸的物质的量浓度 ③完全中和时,消耗NaOH的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.14gC2H4含有的单键数目为3NA
B.99℃时,1LpH=6的纯水中,含有的OH-数目为1×10-8NA
C.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA
D.100 g CaS与CaSO4的混合物中含有32 g硫,则含有的氧原子数为1.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。
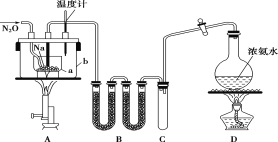
已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为______。
(2)步骤①中先加热通氨气的目的是_______________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为__________;步骤③中最适宜的加热方式为 ______(填“水浴加热”,“油浴加热”)。
(3)生成NaN3的化学方程式为 _______。
(4)图中仪器a用的是铁质而不用玻璃,其主要原因是_____。
(5)步骤④中用乙醚洗涤的主要目的是_______。
(6)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大。A原子是元素周期表中原子半径最小的原子;B可以与A形成常温下常见的液态物质;C原子的最外层电子数为比最内层电子数少1;D单质在空气中点燃发出耀眼的白光;E是第3周期非金属性最强的元素。
(1)A、B形成的具有强氧化性的18电子的物质的电子式为:___________
(2)C、D最高价氧化物的水化物的碱性__>__。(填化学式)
(3)B、C形成的简单离子半径大小__>__。(填具体离子符号)
(4)E的最高价氧化物的水化物与D的最高价氧化物的水化物在溶液中反应的离子方程式___________
(5)写出化合物CE的形成过程为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的是
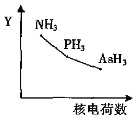
A. 相对分子质量B. 稳定性C. 沸点D. R-H键长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示,则下列说法不正确的是( )
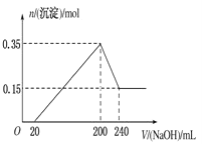
A.镁和铝的总质量为9g
B.最初20mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.0molL1
D.生成的氢气在标准状况下的体积为10.08L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对可逆反应:2NO2(g) ![]() 2NO(g) +O2(g) ΔH=- 1162kJ·mol-1的影响,若保持气体的总质量不变,在温度为T1、T2时,通过实验得到平衡体系中 NO体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是( ):
2NO(g) +O2(g) ΔH=- 1162kJ·mol-1的影响,若保持气体的总质量不变,在温度为T1、T2时,通过实验得到平衡体系中 NO体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是( ):

A. a、c两点混合气体的平均相对分子质量:Ma>Mc
B. b、c两点的平衡常数:Kb=Kc
C. 从状态a到状态c,NO2气体的转化率减小
D. 状态a通过升高温度可变成状态b,a、b两点气体颜色:a深、b浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com