
【题目】氮、磷、砷是同族元素,请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为:_____________(用元素符号表示)。
(2)氨水溶液中存在多种氢键,任意表示出其中一种:____________________。
(3)PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似。下列对PH3与HI反应产物的推断正确的是___________(填序号)。
a.不能与NaOH反应 b.含离子键、共价键 c.能与水反应
(4)氮原子间能形成氮氮三键,而砷原子间不易形成三键的原因:_____________________。
(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。
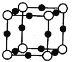
①X的核外电子排布式为________________________。与同一个N3-相连的X+有______个。
②X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为_____。
③请画出[X(H2O)4]2+离子的结构式_________________(用元素符号写结构式)。
【答案】C<O<N O-H┄N(或O-H┄O、N-H┄O、N-H┄N) bc 砷原子半径较大,原子间形成的δ键较长,p-p轨道肩并肩重叠程度较小或难以重叠,难以形成π键 ls22s22p63s23p63d104s1 6 配位键 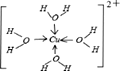
【解析】
第一电离能是指基态气态原子失去最外层一个电子所需能量,同一周期,大体呈从左往右增大的规律,氮的2p能级半满,更稳定;氢键是H与N、O、F原子之间形成的一种特殊键,物质中有O-H、N-H、F-H键均可形成氢键;PH3与HI反应可以通过NH3与HCl过分析,产物是NH4Cl,分析NH4Cl具有的性质;在元素周期表中,同一主族从上到下,原子半径增大,π键是p-p轨道肩并肩重叠形成的; X+中所有电子正好充满K、L、M三个电子层,则有2+8+18=28个电子,则X为29号元素铜,根据晶体结构图可以推断出黑色小球代表X+,白色小球代表N3-,X2+有空轨道,H2O中氧原子有孤电子对,X2+与H2O之间形成配位键,氧原子有孤电子对,所以配位键由氧指向X,配位数为4。
(1)第一电离能是指基态气态原子失去最外层一个电子所需能量,同一周期,大体呈从左往右增大的规律,氮的2p能级半满,更稳定,所以氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为:C<O<N;
故答案为:C<O<N;
(2) 氢键是N、O、F原子之间形成的一种特殊键,氨水溶液中与均可以形成氢键,所以有以下四种:水与水:O-H┄O,水与氨:O-H┄N,氨与氨:N-H┄N,氨与水:N-H┄O,以上任一种均可;
故答案为:O-H┄N(或O-H┄O、N-H┄O、N-H┄N);
(3) PH3和NH3与卤化氢的反应相似,产物的结构和性质也相似,PH3与HI反应的产物性质推断,可以用NH3与HCl的反应产物NH4Cl来分析,NH4Cl可以与NaOH反应,且NH4Cl含离子键、共价键,铵根会发生水解反应,所以选bc;
故答案为:bc;
(4) 在元素周期表中,同一主族从上到下,原子半径增大,砷原子的半径更大,若形成三键,则含δ键和π键,半径越长,p-p轨道肩并肩重叠越难,所以砷原子不易形成三键;
故答案为:砷原子半径较大,原子间形成的δ键较长,p-p轨道肩并肩重叠程度较小或难以重叠,难以形成π键;
(5) ①X+中所有电子正好充满K、L、M三个电子层,则有2+8+18=28个电子,则X为29号元素铜,铜的核外电子排布式为:ls22s22p63s23p63d104s1,根据晶体结构图可以推断出黑色小球代表X+,白色小球代表N3-,故同一个N3-相连的X+有6个(上下左右前后);②X2+有空轨道,H2O中氧原子有孤电子对,故二者之间形成配位键;③X2+与H2O之间形成配位键,氧原子有孤电子对,所以配位键由氧指向X,配位数为4,故结构简式为: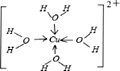 ;
;
故答案为:ls22s22p63s23p63d104s1 ; 6 ;配位键;  。
。


科目:高中化学 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置制备一硝基甲苯。
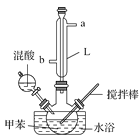
实验步骤如下:
①配制浓硫酸和浓硝酸(按体积比1∶3)的混合物(混酸);
②在三颈瓶里装15 mL甲苯;
③装好其他药品,并组装好仪器;
④向三颈瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯。(已知:甲苯的密度为0.866 g·cm-3,沸点为110.6 ℃;硝基苯的密度为1.20 g·cm-3,沸点为210.9 ℃)
根据上述实验,回答下列问题:
(1)实验方案中缺少一个必要的仪器,它是________。本实验的关键是控制温度在30 ℃左右,如果温度过高,产生的后果是__________________________。
(2)简述配制混酸的方法:________________________________,浓硫酸的作用是_________________。
(3)L仪器名称是________,进水口是________。
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:______________,反应类型为:________。
(5)分离产品方案如下:

操作1的名称是________。
(6)经测定,产品1的核磁共振氢谱中有3个峰,则其结构简式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,有下列五种溶液:A.0.1mol/LNH4Cl B.0.1mol/L CH3COONH4 C.0.1mol/LNH4HSO4 D.0.1mol/LNH4HCO3 E.0.1mol/LNaHCO3
请根据要求填写下列空白:
(1)溶液A呈___性(填“酸”、“碱”或“中”),其原因是:___(用离子方程式表示)。
(2)溶液E呈___性(填“酸”、“碱”或“中”),其原因是:___(用离子方程式表示)。
(3)比较溶液A、C中c(NH4+)的大小关系是A___C(填“>”、“<”或“=”)。
(4)常温下,测得溶液B的pH=![]() ,则CH3COO-的水解程度___NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)___c(NH4+)(填“>”、“<”或“=”)。
,则CH3COO-的水解程度___NH4+的水解程度(填“>”、“<”或“=”),CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)___c(NH4+)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列叙述中正确的是
A.溶液中:c(H+)=c(OH-)+c(SO42-)
B.NaHSO4属于酸式盐,加入水中促进水的电离
C.1 mol NaHSO4晶体中含有的离子总数为3NA
D.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是
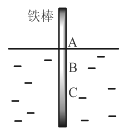
A.铁棒AB段发生反应为O2+ 4e-+ 2H2O = 4OH-
B.腐蚀过程中在铁棒上会产生微电流,且方向是AB段到BC段
C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响
D.产生这种现象的本质原因是铁棒所处的化学环境不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的是 ( )
A. 加入适量纯CH3COOH
B. 加入少量NaCl固体
C. 加入少量NaOH固体
D. 加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机化合物的说法错误的是
A.有机化合物的分子结构决定于原子间的连接顺序、成键方式和空间排布
B.在同一有机化合物分子中原子团之间存在相互影响
C.有机化合物分子中基团之间的相互影响不会导致键的极性发生改变
D.碳原子的结构特征使有机化合物具有与无机物不同的性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置(气密性已检查)制备Fe(OH)2白色沉淀。
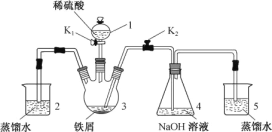
请回答:
(1) 仪器1的名称________。装置5的作用________。
(2) 实验开始时,关闭K2,打开K1,反应一段时间后,再打开K2,关闭K1,发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中________。
(3) 装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com