
 欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.
欲配制500mL 0.5mol•L-1的NaOH溶液,试回答下列问题.分析 (1)依据m=CVM计算需要氢氧化钠的质量;
(2)称量前把游码放在标尺的零刻度,天平静止时发现指针在分度盘的偏右位置,说明左边托盘质量小于右边托盘质量,则右边托盘下降;欲使天平平衡,需要向左盘添加药品;托盘天平的感量是0.1g;
(3)游码的质量是2.6g;
(4)实验操作的步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签据此排序;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1).配制500mL 0.5mol•L-1的NaOH溶液,需要氢氧化钠的质量m=0.5mol/L×40g/mol×0.5L=10.0g;
故答案为:10.0g;
(2).称量前把游码放在标尺的零刻度,天平静止时发现指针在分度盘的偏右位置,说明左边托盘质量小于右边托盘质量,则右边托盘下降,所以左盘高于右盘;欲使天平平衡,需要向左盘添加药品;托盘天平的感量是0.1g,所以称量药品质量为32.6g,
故答案为:高于;往左盘添加药品;32.6g;
(3)游码的质量是2.6g,其图为 ,
,
故答案为: ;
;
(4)配制一定物质的量浓度溶液一般步骤:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,所以正确的顺序为:①③④②⑤;
(5)A.使用滤纸称量NaOH固体,导致称取的氢氧化钠质量偏小,溶质的物质的量偏小,溶液浓度偏低,故A选;
B.容量瓶中原来存有少量水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B不选;
C.溶解后的烧杯未经多次洗涤,导致溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故选;
D.用胶头滴管加水定容时仰视刻度,导致溶液体积偏大,溶液浓度偏低,故D选;
故选:ACD.
点评 本题考查一定物质的量浓度溶液配制,侧重考查基本操作及误差分析,注意托盘天平的感量及误差分析,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol OT-含有的质子数、中子数均为10NA | |
| B. | 25℃,101kPa时,4.90LNH3含有的分子数约为0.2NA | |
| C. | 常温常压下,6g二氧化硅中所含硅氧键数目为0.2NA | |
| D. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 某钾盐晶体中滴入浓盐酸,产生的气体通入品红溶液 | 品红溶液褪色 | 产生的气体一定是SO2 |
| B | 用磁铁吸引氧化铁与铝粉发生铝热反应后的黑色产物 | 能被磁铁吸引 | 黑色熔化物中含铁、四氧化三铁中的1种或2种 |
| C | 向某硫酸盐溶液中滴入酸性H2O2溶液,再滴入KSCN溶液 | 溶液变为红色 | 该硫酸盐一定为FeSO4 |
| D | 某品牌加碘食盐的溶液中,加入淀粉,并通入NO2 | 溶液变为蓝色 | 该加碘食盐中碘的存在形式为IO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
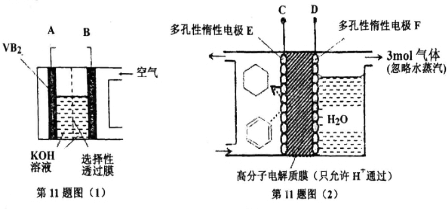
| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
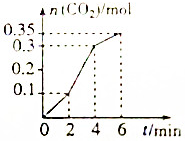 CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )| A. | 反应开始2min内平均反应速率最大 | |
| B. | 可用c(Ca2+)或c(H+)的变化表示该反应速率 | |
| C. | 反应4min后平均反应速率减小 | |
| D. | 反应在第2min到第4min间生成CO2的平均反应速率为v${\;}_{C{O}_{2}}$=0.1mol/min |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量烧碱固体 | B. | 降低温度 | C. | 加少量冰醋酸 | D. | 加水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )
常温下,向浓度相同、体积均为1L的MOH和ROH溶液,分别加水稀释至体积V,pH随1gV的变化如图所示,下列叙述错误的是( )| A. | MOH是强碱,ROH是弱碱 | |
| B. | 原ROH溶液的浓度为1.0mol/L | |
| C. | 常温下,ROH的电离平衡常数Kb约为1.1×10-5 | |
| D. | 当1gV=2时,若两溶液同时升高温度,则$\frac{c({M}^{+})}{c({R}^{+})}<10$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com