
����Ŀ����������ѧ������ʵ���е�Ӧ���������֪ʶ��ա�
��1������6��02��1023����ԭ�ӵ�H2SO4�����ʵ�����___________��
��2�����״����V LCO2������ԭ����Ŀ��ͬ��ˮ��������___________g���÷�ʽ��ʾ��
��3����NAΪ�����ӵ���������ֵ�����a g�����к��еķ�����Ϊb����c g�����ڱ�״���µ����Լ��________(�ú�NA��ʽ�ӱ�ʾ)��
��4����4 g NaOH�ܽ���ˮ�����10 mL��Һ����ϡ�ͳ�1 L������ȡ��10 mL����10 mL��Һ�����ʵ���Ũ��Ϊ_______��
��5�������Ϊ1��2��3���Ȼ��ơ��Ȼ�þ���Ȼ�����Һ���ֱ������������Ũ�ȵ���������Һ����ǡ����ȫ��Ӧ�����Ȼ�������������������Һ�����ʵ���Ũ��֮��Ϊ_________��
���𰸡�0.25mol 9V/5.6 ![]() L 0.1mol/L 36��9:4
L 0.1mol/L 36��9:4
��������
n=![]() =
=![]() =cV���м��㡣
=cV���м��㡣
��1��һ��H2SO4�к���4����ԭ�ӣ�����6.02��1023����ԭ�ӣ�������ķ��Ӹ���Ϊ0.25NA����0.25mol��
��2����״����V LCO2�����ʵ���Ϊ![]() mol�����е���ԭ�ӵ����ʵ���Ϊ
mol�����е���ԭ�ӵ����ʵ���Ϊ![]() mol��һ��ˮ�����к���һ����ԭ�ӣ���ˮ�����ʵ�������ԭ�ӵ����ʵ�����ͬ����
mol��һ��ˮ�����к���һ����ԭ�ӣ���ˮ�����ʵ�������ԭ�ӵ����ʵ�����ͬ����![]() mol��������Ϊ
mol��������Ϊ![]() mol��18g/mol=
mol��18g/mol=![]() g��
g��
��3��a g�����к��еķ�����Ϊb����c g�������еķ�����Ϊ![]() ������n��O2��=
������n��O2��=![]() =
=![]() mol��V��O2��=n��O2��
mol��V��O2��=n��O2��![]() 22.4L/mol=
22.4L/mol=![]() L��
L��
��4��c=![]() =
=![]() =0.1mol/L����Һ���о�һ�ԡ��ȶ��ԣ���ȡ��10mL��Һ��Ũ����ԭ��Һ��ͬ����0.1mol/L��
=0.1mol/L����Һ���о�һ�ԡ��ȶ��ԣ���ȡ��10mL��Һ��Ũ����ԭ��Һ��ͬ����0.1mol/L��
��5���Ȼ��ơ��Ȼ�þ���Ȼ����к��е�Cl-�����ʵ���֮��Ϊ1��2��3��������������Ũ�ȵ���������Һ����ǡ����ȫ��Ӧ�����Ȼ�����������NaCl![]() MgCl2
MgCl2![]() AlCl3
AlCl3![]() AgCl�����Ȼ��ơ��Ȼ�þ���Ȼ��������ʵ���֮��Ϊ6��3��2���Ȼ��ơ��Ȼ�þ���Ȼ�����Һ�������Ϊ1��2��3�����Ȼ��ơ��Ȼ�þ���Ȼ�����Һ���ʵ���Ũ��֮��Ϊ36��9��4��
AgCl�����Ȼ��ơ��Ȼ�þ���Ȼ��������ʵ���֮��Ϊ6��3��2���Ȼ��ơ��Ȼ�þ���Ȼ�����Һ�������Ϊ1��2��3�����Ȼ��ơ��Ȼ�þ���Ȼ�����Һ���ʵ���Ũ��֮��Ϊ36��9��4��


 �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�����ֻ��Է�Ӧ�м������ӣ����ǵ������о�����1��̼ԭ�Ӻ�3����ԭ�ӡ�����������������������������ģ�ͣ�д����Ӧ�Ļ�ѧʽ��
 ___________��
___________�� ______________��
______________��
(2)��Ҫ��д���ڶ����ڷǽ���Ԫ�ع��ɵ����Է��ӵĻ�ѧʽ��
ƽ�������η���___________�������η���____________�����������η���_____________��
(3)д��SO3�ij����ĵȵ�����Ļ�ѧʽ��һ��������____________ (д��һ�֣���ͬ)������������____________�����ǵ�����ԭ�Ӳ��õ��ӻ���ʽ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ��CuS��MnS��ˮ�еij����ܽ�ƽ��������ͼ��ʾ������˵���������
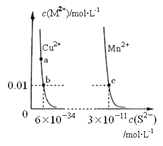
A. a���Ӧ��Ksp����b���Ӧ��Ksp
B. ��CuSO4��Һ�м���MnS�������·�Ӧ��Cu2+��aq��+MnS��s��=CuS��s��+Mn2+��aq��
C. �ں���CuS��MnS�������Һ��c��Cu2+����c��Mn2+��=2��10��23��1
D. ���¶��£�Ksp��CuS��С��Ksp��MnS��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������������ȷ���ǣ� ��
A. ��״���£�1molFe�ֱ��������������ˮ������Ӧת�Ƶĵ�������Ϊ2NA
B. 11.2LH2�к��е�ԭ����ΪNA
C. Na2O��Na2O2�Ļ���ﹲ1mol����������ĿΪNA
D. 1.0L1mol/L��Na2SO4ˮ��Һ�к��е���ԭ����ĿΪ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ������˵���в���ȷ����
A. 14g��N2��13C2H2��ɵĻ�����У�����������Ϊ7NA
B. CH4�����(P4)��Ϊ��������ṹ����1mol CH4��lmolP4�������ۼ�����Ŀ��Ϊ4NA
C. ��ӦN2(g)+3H2(g)![]() 2NH3(g) ��H=-92.4kJ/mol�����ų�����4.62kJ����ת�Ƶ��ӵ���ĿΪ0.3NA
2NH3(g) ��H=-92.4kJ/mol�����ų�����4.62kJ����ת�Ƶ��ӵ���ĿΪ0.3NA
D. �����£���0.5molNH4NO3��xmolNH3��H2O��������Һ�У�����NH4+����ĿΪ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1.0 mol/L������ε��뵽100 mL����NaOH��NaAlO2��Na2CO3�Ļ����Һ�У���Ӧ������ͼ��ʾ�������й�˵������ȷ����
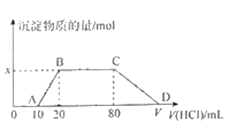
A. ���Һ��NaOH�����ʵ���Ũ��Ϊ0.1 mol/L
B. x��0.01
C. BC�εķ�Ӧ�������ӷ���ʽΪ��CO![]() ��H+ ====HCO
��H+ ====HCO
D. V��110
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ�е�c(SO42��)��50mL1mol��L��1Al2(SO4)3��Һ�е�c(SO42��)��ȵ���
A. 150mL1mol��L��1Na2SO4��Һ
B. 75mL2mol��L��1(NH4)2SO4��Һ
C. 150mL3mol��L��1K2SO4��Һ
D. 20mL1.5mol��L��1Fe2(SO4)3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A(g)��B(g)![]() 2C(g)����H����akJ/mol(a��0)����һ���д����Ĺ̶��ݻ��������м���2molA��1molB����500��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ��mol/L���ų�����ΪbkJ��
2C(g)����H����akJ/mol(a��0)����һ���д����Ĺ̶��ݻ��������м���2molA��1molB����500��ʱ��ַ�Ӧ��ƽ���C��Ũ��Ϊ��mol/L���ų�����ΪbkJ��
(1)�Ƚ�a__b(����������������������)��
(2)������Ӧ�¶����ߵ�700�棬�÷�Ӧ��ƽ�ⳣ����___________(��������������С������������)��
(3)������˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����__________��
a. v(C)=2 v(B)b. ����������ѹǿ���ֲ���
c. v��(A)=2v��(B) d.�����������ܶȱ��ֲ���
e.�����������ƽ����Է����������ֲ���
(4)Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ��IJ�����______________��
a. ��ʱ�����C����b. �ʵ������¶�
c. ����B��Ũ��d. ѡ���Ч����
(5) ��������������Ϊ��ѹ����(��Ӧǰ�����ͬ)����ʼʱ����2molA��1molB��500��ʱ��ַ�Ӧ��ƽ��ų�����ΪdkJ����d___b(����������������������)��������______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ͭ��Һ�к���һ������CuSO4�������ŷŻ���Ⱦ���������õ绯ѧԭ���ɶԷ�Һ���л��մ�����װ����ͼ���������ӽ���Ĥֻ����H+ͨ������֪����Cu2++ HCHO + 3OH��=Cu + HCOO��+ 2H2O������ԭ�ԣ�HCHO > M(���ֽ�����> Cu��
����˵����ȷ����
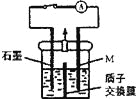
A. ��Ӧ֮ǰ��Ӧ����OH����HCHO��Һ���뵽װ�õ����
B. �Ҳ���ĵ缫��Ӧʽ��HCHO-2e��+H2O=HCOO��+3H+
C. �������ӽ���Ĥ���������ӽ���Ĥ���ŵ�����У�������OH���������Ǩ��
D. �ŵ�һ��ʱ�����أ���ȥ���ӽ���Ĥ��װ���п��ܻ��к�ɫ���塢��ɫ��״�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com