
【题目】已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应.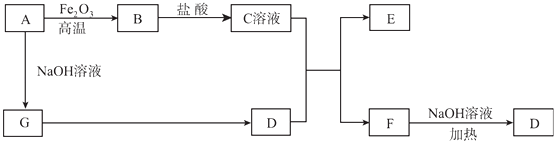
请回答下列问题:
(1)写出F的电子式:;
(2)①C溶液与D的水溶液反应的离子方程式为;②F溶液与NaOH溶液共热反应的化学方程式为;
(3)①请用离子方程式解释C溶液为何显酸性;②F溶液中离子浓度由大到小的顺序为;
(4)将5.4 g A投入到200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是(填代号);
A.HNO3溶液
B.H2SO4溶液
C.NaOH溶液
D.HCl溶液
(5)将1mol N2和3mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得D的物质的量浓度为a mol/L.在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5mol G达到平衡后,D的物质的量浓度(填“大于”“小于”或“等于”)a/2mol/L.
【答案】
(1)![]()
(2)Al3++3NH3?H2O=Al(OH)3↓+3NH4+;NH4Cl+NaOH ![]() NaCl+NH3↑+H2O
NaCl+NH3↑+H2O
(3)Al3++3H2O?Al(OH)3+3H+;c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣)
(4)D
(5)小于
【解析】解:A~G有如图所示的转化关系(部分生成物已略去),D是能使湿润的红色石蕊试纸变蓝色的气体,则D为NH3 , 其中A、G为单质,且A与氧化铁反应,与氢氧化钠反应反应得到G,G反应可以得到氨气,可推知A为Al、G为H2 , E、F均能与NaOH溶液反应,结合转化关系可知,故B为Al2O3 , C为AlCl3 , E为Al(OH)3 , F为NH4Cl,(1)F为NH4Cl,电子式为: ![]() ,所以答案是:
,所以答案是: ![]() ;(2)①C溶液与D反应的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+ , 所以答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
;(2)①C溶液与D反应的离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+ , 所以答案是:Al3++3NH3H2O=Al(OH)3↓+3NH4+;
②F溶液与NaOH溶液共热反应的化学方程式为:NH4Cl+NaOH ![]() NaCl+NH3↑+H2O,
NaCl+NH3↑+H2O,
所以答案是:NH4Cl+NaOH ![]() NaCl+NH3↑+H2O;(3)①AlCl3溶液中铝离子水解:Al3++3H2OAl(OH)3+3H+ , 平衡水的电离平衡,溶液呈酸性,
NaCl+NH3↑+H2O;(3)①AlCl3溶液中铝离子水解:Al3++3H2OAl(OH)3+3H+ , 平衡水的电离平衡,溶液呈酸性,
所以答案是:Al3++3H2OAl(OH)3+3H+;
②NH4Cl溶液中铵根离子水解,溶液呈酸性,故溶液中离子浓度由大到小的顺序为:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣),
所以答案是:c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣);(4)将5.4g Al的物质的量= ![]() =0.2mol,200mL 2.0mol/L某溶液中溶质的物质的量=0.2L×2mol/L=0.4mol,将Al投入该溶液中有G单质产生,且充分反应后有金属剩余,Al与稀硝酸反应没有气体单质生成,与稀硫酸、氢氧化钠、盐酸反应都生成氢气,
=0.2mol,200mL 2.0mol/L某溶液中溶质的物质的量=0.2L×2mol/L=0.4mol,将Al投入该溶液中有G单质产生,且充分反应后有金属剩余,Al与稀硝酸反应没有气体单质生成,与稀硫酸、氢氧化钠、盐酸反应都生成氢气,
由2Al~3H2SO4可知,0.2molAl完全反应消耗H2SO4 的物质的量=0.3mol<0.4mol,故Al没有剩余,
由2Al~2NaOH可知,0.2molAl完全反应消耗NaOH的物质的量=0.2mol<0.4mol,故Al没有剩余,
由2Al~6HCl可知,0.2molAl完全反应消耗HCl的物质的量=0.6mol>0.4mol,故Al有剩余,
所以答案是:D;(5)将1molN2和3molH2和及催化剂充入容积为2L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得NH3的物质的量浓度为a mol/L,在其他条件不变的情况下,若起始时充入0.5molN2和1.5molH2达到平衡等效为在原平衡基础上体积扩大一倍,压强减小,平衡向生成氮气、氢气的方向移动,故NH3的物质的量浓度小于0.5amol/L,所以答案是:小于.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:
【题目】将0.05mol SO2(g)和0.03mol O2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04molL﹣1 . 以下表述正确的是( )
A.该条件下反应的平衡常数为1.6×103
B.通常情况下,该反应一定能自发进行
C.题给条件下,O2的转化率是20%
D.当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.亚甲基蓝和亚甲基白在碱性条件下都不能稳定存在
B.亚甲基蓝变为亚甲基白后,通常不能再复原为亚甲基蓝
C.亚甲基白变为亚甲基蓝后,通常不能再复原为亚甲基白
D.亚甲基白不稳定,能缓慢释放出氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每个方格表示有关的一种反应物或生成物,M分解生成A、B、C的物质的量之比为l:l:1,其中A和C为无色气体。
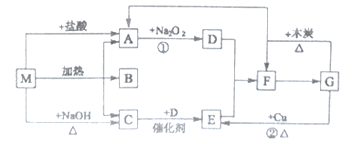
(1)物质M是__________(写名称),C是_____________(写化学式);
(2)M与盐酸反应生成A的离子方程式:_______________________________;
(3)反应②的离子方程式:_________________________________________________;
(4)G与木炭反应的化学方程式:_________________________________________;
(5)F生成G的化学方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1mol NaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)P(g)+Q(g) H>0,请回答下列问题:
(1)在某温度下,反应物起始浓度分别为:c(M)=1molL﹣1 , c(N)=2.4molL﹣1 , 达到平衡后,M的转化率为60%,此时N的转化率为
(2)若反应温度升高,转化率(填“增大”、“减少”或“不变”).
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4molL﹣1 , c(N)=a molL﹣1;达到平衡后,c(P)=2molL﹣1 , a= .
(4)若反应温度不变,反应物的起始浓度分别为:c(M)=1molL﹣1 , c(N)=0.3molL﹣1;达到平衡后,M的转化率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学化学兴趣小组学生在学习“含硫化合物的性质和应用”时,进行了如下实验探究:为了验证浓硫酸和碳在加热的情况下反应的生成物,用图Ⅰ装置进行实验。

(1)请写出碳与浓硫酸反应的化学反应方程式_________________________________;该反应中氧化剂与还原剂的物质的量之比为_____________;
(2)图Ⅰ中A处是完成实验中的必要装置,它是下图所示中的_________;(填编号)
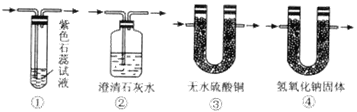
(3)图Ⅰ中C装置中应盛的试剂最好为:足够的_______________,其作用是__________________;
(4)若出现_______________________ 的实验现象,则可以确定存在二氧化碳气体。
(5)现实验小组的同学继续进行实验,他们将二氧化硫和氯气按一定的比例同时通入品红溶液中,一段时间后,发现品红溶液没有褪色。试分析实验过程中,品红不褪色的原因___________________(用离子反应方程式表示);你认为怎么样做可以让品红的颜色越来越浅?_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com