
【题目】自来水常用氯气消毒,某学生用这种自来水去配制下列物质溶液,不会产生明显的药品变质问题的是 ( )
A. AgNO3 B. FeCl2
C. NaHSO3 D. NaNO3
【答案】D
【解析】
自来水中,氯气与水发生反应:Cl2+H2O![]() HClO+HCl,溶液中含有Cl2、HClO、H2O等分子;含有:Cl-、H+、ClO-等离子,结合对应粒子的性质解答该题。
HClO+HCl,溶液中含有Cl2、HClO、H2O等分子;含有:Cl-、H+、ClO-等离子,结合对应粒子的性质解答该题。
A.氯水中含有Cl-,加入硝酸银生成氯化银沉淀,不能用于配制AgNO3溶液,故A错误;
B.因氯水中含有Cl2、HClO、ClO-等微粒,具有氧化性,可与FeCl2发生氧化还原反应,则产生明显的药品变质问题,不能用于配制FeCl2溶液,故B错误;
C.因氯水中含有H+,可与NaHSO3发生反应生成二氧化硫气体,不能用于配制NaHSO3溶液,故C错误;
D.因氯水中含有的微粒不会与NaNO3溶液中的微粒发生反应,则不会产生明显的药品变质问题,故D正确。
故选D。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】观察下图,下列叙述正确的是
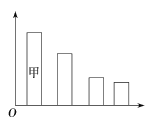
A. 若该图表示的是活细胞的各化学元素的含量,则甲应该为碳元素
B. 若该图表示的是细胞的各化学元素占干重的百分比,则甲应该为氧元素
C. 若该图为活细胞的化合物组成情况,则甲中含有的元素为C、H、0
D. 若该图是已经完全脱水后的细胞的化合物组成情况,则甲是蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某铜银合金的组成,将30.0g合金溶于80.0mL 13.5mol·L1的浓HNO3中。待合金完全溶解后,收集到气体6.72L(标准状况下)并测得H+浓度为1mol·L1。假设反应后溶液的体积为80.0mL,试计算:
(1)被还原的硝酸的物质的量___________;
(2)合金中银的质量分数___________。
(3)确定6.72L气体中各成分的物质的量___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,mg下列物质在足量的氧气中充分燃烧后,产物与足量的过氧化钠充分反应,过氧化钠增加了ng,且n>m,符合此要求的物质是( )
①H2 ②HCHO ③CH4 ④HCOOCH3⑤CH3CHO
A. ①② B. ③⑤ C. ①②③④⑤ D. ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应产物已略去)。
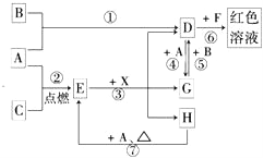
(1)写出下列物质的化学式:D___________,X_______________。
(2)在反应①~⑦中,不属于氧化还原反应的是_____________(填编号)。
(3)反应⑥的离子方程式为:______________________________________。
(4)往G溶液中加入NaOH溶液观察到的现象是________________________。
(5)反应⑦的化学方程式为____________________________________;该反应中每消耗0.3mol的A,可转移电子________mol。
(6)除去D溶液中混有的少量G的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)FeCl3溶液中加入铁粉,溶液由___色变为___色,该反应的离子方程式为______;
(2)除去FeCl3溶液中混有的FeCl2需向溶液中通入______(填物质名称),该反应的离子方程式为______;
(3)在Fe3O4 +4CO![]() 3Fe+4CO 2的反应中,_____是氧化剂,被氧化的元素为____,氧化产物是________,若有11.6g Fe3O4参加反应则转移电子的物质的量为__________。
3Fe+4CO 2的反应中,_____是氧化剂,被氧化的元素为____,氧化产物是________,若有11.6g Fe3O4参加反应则转移电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2O为国际公认高效安全灭菌消毒剂之一,它是棕黄色强刺激性气体,沸点3.8℃熔点-116℃。实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O,装置如下(图Ⅰ):

回答下列问题:
(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2。请模仿“图Ⅱ”在“图Ⅰ”A处补画出正确的装置图,并作必要的标注。_______
(2)B中试剂a应选用______(填下列序号字母)。
a.CCl4 b.饱和NaCl溶液 c.浓H2SO4 d.饱和NaHCO3溶液
(3)通入适量的氯气,在C中生成棕黄色的物质Cl2O,该物质常温下为气体,方程式为:________
Cl2+ Na2CO3+ == NaHCO3+ NaCl+ Cl2O
(4)对C中反应后的固体成分进行检验,请写出实验步骤以及预期的现象和结论。
限选实验试剂和仪器:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、澄清石灰水、试管、小烧杯、带导管的橡皮塞、过滤装置。
实验步骤 | 现象和结论 |
步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中。 | |
步骤二:向a试管中滴加BaCl2溶液,静置。 | 无明显现象,证明固体中不含Na2CO3 |
步骤三:_______________ | _______________ |
步骤四:_______________ | _______________ 则证明固体中含有NaCl。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1L H2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol/L,则理论上最多能溶解铜的物质的量为
A. 0.40mol B. 0.45mol C. 0.72mol D. 0.80mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
(2)由于金属钠很容易跟空气中的______、________等物质反应,通常将它保存在_______里。
(3)将一小块钠投入到下列溶液中,既能产生气体又会出现白色沉淀的是________(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。
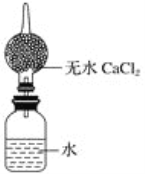
①列出计算钠相对原子质量的数学表达式______________(用含有a、b、c的算式表示)。
②无水氯化钙的作用是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com