
| A. | 肥皂中含有甘油(氯化钠、盐析) | B. | 乙醇中含有水(氧化钙、蒸馏) | ||
| C. | 溴苯含有溴(氢氧化钠溶液、分液) | D. | 苯中含有苯酚(浓溴水,过滤) |
分析 A.加NaCl可降低高级脂肪酸盐的溶解度;
B.加CaO与水反应后,增大与乙醇的沸点差异;
C.溴与NaOH反应后,与溴苯分层;
D.苯酚、溴、三溴苯酚均易溶于苯.
解答 解:A.加NaCl可降低高级脂肪酸盐的溶解度,发生盐析可分离,故A正确;
B.加CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可分离,故B正确;
C.溴与NaOH反应后,与溴苯分层,然后分液可分离,故C正确;
D.苯酚、溴、三溴苯酚均易溶于苯,不能除杂,应选NaOH、分液,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的化学反应、混合物分离提纯方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中含有1mol Na2SO4 | |
| B. | 将1mol Na2SO4溶于1L中可得到该溶液 | |
| C. | 溶液中Na+的物质的量浓度为2mol•L-1 | |
| D. | 1L该溶液中含有2mol Na+和2mol SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴加在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氢氧化镁溶解于盐酸:OH?+H+═H2O | |
| C. | 金属铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 铜和硝酸银溶液反应:Cu+2Ag+═2Ag+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯(液溴):加NaOH溶液,充分振荡,分液,留下层液体 | |
| B. | 乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液即可 | |
| C. | 乙烷(乙烯):通过盛有足量溴水溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,留上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2 | B. | K2S | C. | LiCl | D. | Na2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测得容器内压强增大p%,A的转化率也是p% | |
| B. | 恒容容器内平衡后再充入A(g),此平衡逆向移动 | |
| C. | 恒容容器内平衡后再充入等量的A(g),达到新平衡后,容器内压强p’为原平衡容器压强p的2倍 | |
| D. | 恒压容器内平衡后再充入Ar(g),A的转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
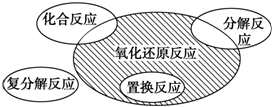 氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题:
氧化还原反应和离子反应是中学化学中重要的反应类型.回答下列问题: =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com