
判断正误,正确的划“√”,错误的划“×”
(1)强电解质溶液的导电性比弱电解质溶液的导电性强( )
(2)BaSO4投入水中, 导电性较弱,故它是弱电解质( )
(3)弱电解质溶液中存在两种共价化合物分子( )
(4)强电解质都是离子化合物,弱电解质都是共价化合物( )
(5)CaO是强电解质,是因为它的水溶液能导电( )
(6)Cl2的水溶液能导电,所以Cl2是电解质( )
答案 (1)× (2)× (3)√ (4)× (5)× (6)×
解析 电解质溶液导电性的强弱与溶液中离子浓度的大小及所带电荷数的多少有关,与电解质强弱没有必然联系,(1)错误;尽管BaSO4难溶于水,但溶解的部分全部电离,故其为强电解质,(2)错误;弱电解质溶液中,有未电离的弱电解质和水这两种共价化合物分子,(3)正确;HCl、H2SO4都是共价化合物但却是强电解质,(4)错误;CaO是强电解质,是因为熔化时能完全电离,能导电,它的水溶液能导电,是因为CaO和H2O反应生成Ca(OH)2,Ca(OH)2能电离出自由移动的Ca2+和OH-,(5)错误;Cl2是单质,(6)错误。


 每课必练系列答案
每课必练系列答案科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,已知X的最高价氧化物对应的水化物化学式为H2XO3,Z的基态原子最外层电子排布式为3s23p1,W的一种核素的质量数为28,中子数为14。
则:(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)Z的第一电离能比W的________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C.用加热的方法可以除去KCl溶液中的Fe3+
D.洗涤油污常用热的碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组对电解质溶液进行如下的归纳总结(均在常温下):
①pH=1的强酸溶液,加水稀释后,溶液中所有离子的浓度一定降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2∶1
③pH相等的四种溶液:a.CH3COONa、b.C6H5ONa、c.NaHCO3、d.NaOH,溶质的物质的量浓度由小到大的顺序为d<b<c<a
④向NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=c(SO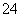 )
)
⑤已知醋酸的电离平衡常数为Ka,醋酸根离子的水解常数为Kh,水的离子积常数为Kw,则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的2倍,则甲、乙两溶液等体积混合,混合溶液的pH可能等于7
其中归纳正确的是( )
A.全部 B.③⑤⑥
C.④⑤⑥ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是( )
A.Cu溶于稀HNO3:Cu+2H++NO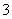 ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO +2H2O===Al(OH)3↓+HCO
+2H2O===Al(OH)3↓+HCO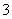
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO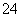 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2:2MnO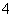 +5H2O2+6H+===2Mn2++5O2↑+8H2O
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-===PbO2+4H++SO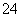
查看答案和解析>>
科目:高中化学 来源: 题型:
离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在______(填序号)。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
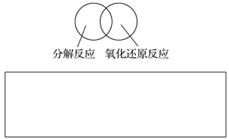
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-===H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO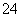 ===BaSO4↓” 来表示,请写出有关反应的化学方程式(3个):
===BaSO4↓” 来表示,请写出有关反应的化学方程式(3个):
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.NH3是极性分子,分子中N原子是在3个H原子所组成的三角形的中心
B.CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子不处在2个O原子所连成的直线的中央
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com