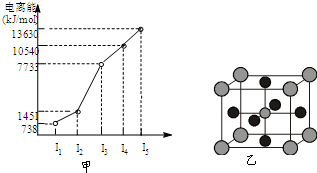
有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为ns
nnp
n.
请回答下列问题:
(1)X原子的电子排布式为
.
(2)第一电离能:X
Y(选填“>”、“<”或“=”).
(3)元素W的一种氢化物(化学式为W
2H
4)是重要的化工原料.有关W
2H
4分子的说法正确的是
(填字母).
A.分子中含有氢键 B.属于非极性分子
C.含有4个σ键和1个π键 D.W的原子与氢原子形成的化学键可以自由旋转
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶胞(晶体中最基本的重复单元)示意图如图乙所示.(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心).该晶体中,钛离子和周围
(填数字)个氧离子相紧邻;已知该晶体的密度为ρ g/cm
3,阿伏加德罗常数为N
A,则晶胞中两个Ti原子的最近距离为
cm.
(5)Z的气态氢化物分子中Z原子采用
杂化;已知NH
4Cl晶体中含有多种化学键,其中一定不含有的化学键是
(填字母).
A.离子键 B.非极性键C.配位键 D.极性键 E.金属键.

 有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.
有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.



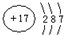


 有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答:
有X、Y、Z、W四种短周期元素,原子序数依次增大.X的阳离子就是一个质子.Z、W在周期表内处于同一周期相邻位置.它们的单质在通常状况下均为无色气体.Y原子的最外层电子数是次外层电子数的2倍.请回答: