
 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、大烧杯、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.分析 Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,反应中Cu被氧化,为原电池的负极,则正极可为碳棒或不如Cu活泼的金属,电解质溶液为氯化铁溶液,正极发生还原反应,负极发生氧化反应,以此解答该题.
解答 解:(1)Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+,故答案为:Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+;
(2)Fe3+氧化性比Cu2+强,可发生2Fe3++Cu=2Fe2++Cu2+,Cu被氧化,为原电池的负极,正极Fe3+被还原,正极可为碳棒,电解质溶液为氯化铁,
则原电池装置图可设计为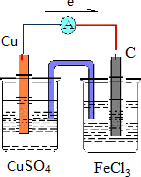 ,电子从铜极流向碳极,故答案为:
,电子从铜极流向碳极,故答案为: ;
;
(3)根据反应:2Fe3++Cu=2Fe2++Cu2+,氧化剂的氧化性强于氧化产物的氧化性,即Cu2+、Fe3+的氧化性由强到弱的顺序为Fe3+>Cu2+,故答案为:Fe3+>Cu2+;
(4)该装置反应一段时间后,当溶液的质量增加3.2g时,即消耗的金属铜质量是3.2g即0.05mol,根据负极反应Cu-2e-=Cu2+,电子转移0.1mol,故答案为:0.1mol.
点评 本题综合考查原电池的设计及原电池的工作原理,为高考常见题型,侧重于学生的分析能力和计算能力的考查,有利于培养学生的良好的科学素养,难度不大,注意从氧化还原反应的角度由电池反应判断电极反应.


科目:高中化学 来源: 题型:选择题
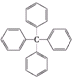 .对该分子的描述正确的是( )
.对该分子的描述正确的是( )| A. | 分子式为C25H20 | B. | 其不是芳香烃 | ||
| C. | 所有碳原子都在同一平面上 | D. | 该物质为脂环烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定互为同分异构体 | B. | 一定互为同系物 | ||
| C. | 实验式一定相同 | D. | 只能是同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 非金属元素组成的化合物中只含共价键 | |
| C. | 第三周期主族元素的最高化合价等于它所在的主族序数 | |
| D. | 短周期元素形成简单离子后,最外层电子都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氯元素的单质及其化合物在生产生活中都很重要.回答下列问题:
氯元素的单质及其化合物在生产生活中都很重要.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | ||
| Y | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com