
| A. | 液氨用作制冷剂 | B. | 四氯化碳萃取碘水中的碘 | ||
| C. | 铁和铝遇到浓硝酸钝化 | D. | 蒸馏法将海水淡化为饮用水 |
分析 化学变化有新物质的生成,物理变化没有新物质生成,据此解答.
解答 解:A.液氨汽化需要吸收大量的热,能做制冷剂,过程中没有新物质生成,属于物理变化,故A错误;
B.四氯化碳萃取碘水中的碘,原理是依据物质在不同溶剂中溶解度不同分离物质,过程中没有新物质生成,属于物理变化,故B错误;
C.浓硝酸具有强的氧化性,与铁、铝发生钝化反应,生成致密氧化膜,过程中有新物质生成属于化学变化,故C正确;
D.蒸馏法将海水淡化为饮用水,依据物质的沸点不同分离物质,过程中没有新物质生成,属于物理变化,故D错误;
故选:C.
点评 本题考查了化学变化与物理变化的判断,明确过程中是否有新物质生成是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 20℃ | K2CO3 | KHCO3 | K2MnO4 | KMnO4 |
| s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
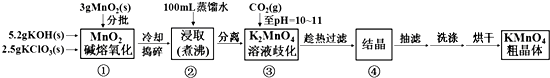
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol•L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol | |
| B. | 0.1 mol水蒸气在标准状况下体积为2.24 L | |
| C. | 在25℃,1.01×105Pa时,11.2 L氧气所含的氧原子数目为6.02×1023 | |
| D. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝元素是在地壳中含量最高的金属元素,储量丰富 | |
| B. | 常温下可以用铝罐盛装浓硫酸 | |
| C. | 铝的冶炼技术基本成熟,可以大量生产 | |
| D. | 从金属活动性顺序来看铝是比较活泼的金属,所以铝丝加热可以在空气中剧烈燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏的方法分离水和油的混合物 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量泥沙 | |
| C. | 用分液的方法分离酒精和水的混合物 | |
| D. | 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 烧碱溶液 | C. | 液氨水 | D. | KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
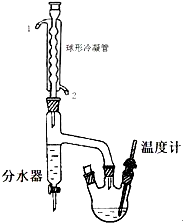 正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:
正丁醚是惰性溶剂,可用作有机合成反应溶剂.某实验小组利用如下装置(夹持和加热装置均省略)合成正丁醚.发生的反应为:| 化合物名称 | 密度(g/mL) | 熔点(℃) | 沸点(℃) | 水中溶解性 |
| 正丁醇 | 0.810 | -89.8 | 118.0 | 微溶 |
| 正丁醚 | 0.7689 | -95.3 | 142 | 不溶于水 |
| 备注:正丁醚微溶于饱和氯化钙溶液. | ||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com