
| A. | 25℃时,l L pH=13的 Ba(OH)2溶液中含有的OH-数为0.2 NA | |
| B. | 18g D2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5 NA |
分析 A、pH=13的氢氧化钡溶液中氢氧根的浓度为0.1mol/L;
B、重水的摩尔质量为20g/mol;
C、根据铁与氯气反应后变为+3价来分析;
D、四氯化碳在标况下为液态.
解答 解:A、pH=13的氢氧化钡溶液中氢氧根的浓度为0.1mol/L,故1LBa(OH)2溶液中含有的氢氧根的物质的量n=CV=0.1mol/L×1L=0.1mol,故个数为0.1NA个,故A错误;
B、重水的摩尔质量为20g/mol,故18g重水的物质的量n=$\frac{18g}{20g/mol}$=0.9mol,而1mol重水中含10mol质子,故0.9mol重水中含9mol质子即9NA个,故B正确;
C、铁与氯气反应后生成FeCl3,铁元素变为+3价,故当生成0.5molFeCl3时,转移1.5mol电子即1.5NA个,故C错误;
D、四氯化碳在标况下为液态,不能根据气体摩尔体积来计算其物质的量,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:选择题
| A. | 恒压下充N2 | B. | 加B | C. | 恒容下充N2 | D. | 加A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该化合物中含有的化学键有离子键、共价键
,该化合物中含有的化学键有离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的盐酸中:c(H+)=4.0mol•L-1 | |
| B. | NH4Cl溶液中:c(Cl-)=c(NH4+) | |
| C. | NaCl溶液中:c(Na+)+c(H+)=c(Cl-)+c(OH-) | |
| D. | Na2CO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 丙炔腈(H-C=C-CN,沸点42.5℃)是一种星际分子,实验室可通过丙炔醇用铬酸酐氧化、盐酸羟胺肟化、再脱水来制备.
丙炔腈(H-C=C-CN,沸点42.5℃)是一种星际分子,实验室可通过丙炔醇用铬酸酐氧化、盐酸羟胺肟化、再脱水来制备.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素:Si、F、Be | B. | 盐:纯碱、碳铵、胆矾 | ||
| C. | 混合物:空气、石油、冰水共存物 | D. | 单质:硫磺、金刚石、水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
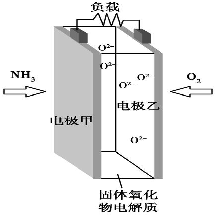 科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为4NH3+5O2═4NO+6H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com