
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.分析 (1)4.48L(标准状况下)SO2的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,而100mL2mol•L-1烧碱溶液中氢氧化钠的物质的量为:0.1L×2mol/L=0.2mol,由反应SO2+NaOH=NaHSO3可知,两者恰好完全反应生成亚硫酸氢钠溶液,NaHSO3溶液呈酸性,说明HS的电离程度大于其水解程度,由此分析解答;根据化合价的变化结合方程式计算;
(2)利用盖斯定律计算反应热,得到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,计算平衡时各物质的浓度,可计算平衡常数;
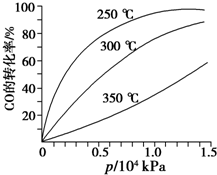
(3)从横坐标上一点,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越低转化率越低,说明,升温时平衡向逆向移动.
解答 解:(1)4.48L(标准状况下)SO2的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,而100mL2mol•L-1烧碱溶液中氢氧化钠的物质的量为:0.1L×2mol/L=0.2mol,由反应SO2+NaOH=NaHSO3可知,两者恰好完全反应生成亚硫酸氢钠溶液,NaHSO3溶液呈酸性,说明HS的电离程度大于其水解程度,故溶液中离子浓度大小为c(Na+)>c(HS)>c(H+)>c(SO32-)>c(OH-),反应6NO2+8NH3?7N2+12H2O中,6NO2中N元素化合价降低,由+4价降低到0价,则6molNO2参加反应,转移24mol电子,所以当转移1.2mol电子时,消耗NH30.4mol,体积为8.96L,
故答案为:c(Na+)>c(HS)>c(H+)>c(SO32-)>c(OH-); 8.96;
(2)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1,利用盖斯定律将①×$\frac{1}{2}$-②×$\frac{1}{2}$得NO2(g)+SO2(g)?SO3(g)+NO(g)
△H=$\frac{1}{2}$×(-196.6kJ•mol-1)-$\frac{1}{2}$×(-113.0kJ•mol-1)=-41.8kJ•mol-1,
a.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故正确;
b.混合气体密度始终保持不变,故错误;
c.SO3和NO的体积比保持不变,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故错误;
d.每消耗1mol SO3等效于生成1mol NO2同时消耗1mol NO2,达到平衡状态,故正确;
故答案为:-41.8; a、d;
(3)从横坐标上一点0.5处,画一条平行于纵坐标的虚线,看相同压强下不同温度时CO的平衡转化率,温度越高转化率越低,说明,升温时平衡向逆向移动.
第二问:实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是工业生产要考虑速经济效益,要考虑速度和效率,压强越大需要的条件越高,花费越大.
故答案为:<;在250℃、1.3×104 kPa的温度和压强下,CO的转化率已经达到90%以上,再需要提高压强会增加设备的强度,影响生产成本.
点评 本题以NO2、SO2、CO等物质为载体,综合考查化学平衡移动、盖斯定律以及平衡常数的计算等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
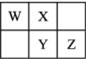 W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )| A. | Y元素氧化物对应水化物的酸性一定弱于Z | |
| B. | W、X、Y中最简单氢化物稳定性最强的是X | |
| C. | X元素形成的单核阴离子还原性大于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
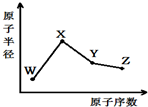
| A. | 最高化合价X>Y>Z>W | |
| B. | 气态氢化物的稳定性Z>Y>W | |
| C. | Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应 | |
| D. | 由X、Z、W三种元素形成的化合物一定既含离子键又含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为N>C>B,电负性由小到大的顺序为B<C<N.
英国科学家安德烈•海姆和康斯坦丁•诺沃肖洛夫因在石墨烯(如图)材料方面的卓越研究而获得2010年诺贝尔物理学奖.六方氮化硼(BN)与石墨是等电子体,它有“白石墨”之称,具有类似石墨的层状结构,有良好的润滑性.C、N、B的第一电离能由大到小的顺序为N>C>B,电负性由小到大的顺序为B<C<N.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 原子个数比 | B:A=1:3 | C:A=1:2 | D:A=1:1 | E:A=1:1 |
| A. | 元素E在元素周期表中的位置为第二周期第ⅦA族 | |
| B. | 原子半径:A<B<C<D | |
| C. | A、C、E中三种元素或任意两种元素形成的物质中只可能含有共价键 | |
| D. | A、B、C、D四元素中的三种能形成多种与甲分子电子数相等的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 | |
| B. | 合成氨工业中使用催化剂,以提高NH3的产量 | |
| C. | 红棕色的NO2加压后颜色先变深再变浅 | |
| D. | CO2(g)?CO2(aq)△H<0,降温增压可增大二氧化碳气体在水中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3mol Na2O2与盐酸反应,转移的电子数为0.6NA | |
| B. | 2L 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.4NA | |
| C. | 标准状况下,4.48L O2所含有的共用电子对数目为0.2NA | |
| D. | 在常温下,0.3mol NaHSO4固体中含有的离子数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l) | B. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l) | ||
| C. | 4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) | D. | 2H2(g)+O2(g)═2H2O(l) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com