
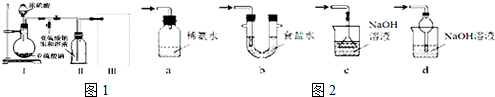

分析 (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性;
(5)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可;
(6)①由消耗碘的量,结合SO2+I2+2H2O═H2SO4+2HI计算二氧化硫的质量,进而计算浓度;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小.
解答 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故a错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故b错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故c错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故d正确;
故答案为:d;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,溶液中离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(5)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(6)①令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 $\frac{0.016g}{0.1L}$=0.16 g/L
故答案为:0.16;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:偏低.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.


科目:高中化学 来源: 题型:选择题
 ,下列关于其结构的叙述中,正确的是( )
,下列关于其结构的叙述中,正确的是( )| A. | 甲烷分子是正方形结构 | B. | 甲烷分子是正四面体结构 | ||
| C. | 甲烷分子是极性分子 | D. | 甲烷分子的四个键不完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下向1 L pH=1的醋酸溶液中加水,所得溶液的H+数目大于0.1NA | |
| B. | 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA | |
| C. | 某无水乙醇与足量金属钠反应生成5.6 L H2,该乙醇分子中共价键总数为4 NA | |
| D. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0 kI/mol,乙烯与H2加成时放出68.5 kJ热量,则反应过程中被破坏的碳原子之间共用电子对数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变、减小 | B. | 增大、减小 | C. | 减小、增大 | D. | 不变、增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径比较:X<Y<Z<W | |
| B. | X2H4与H2W都能使溴水褪色 | |
| C. | X的氢化物的沸点一定低于Y的氢化物的沸点 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
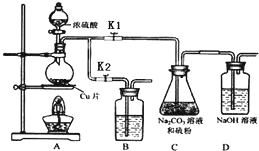 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
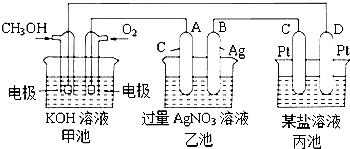 图是一个化学过程的示意图.
图是一个化学过程的示意图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
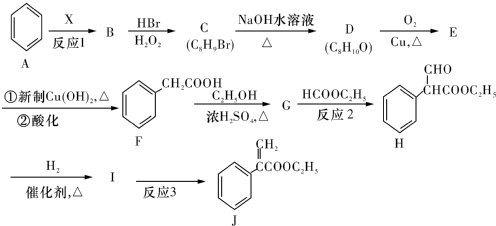
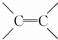 (或碳碳双键).
(或碳碳双键). .
.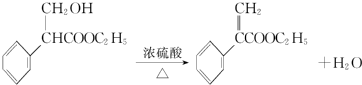 .
.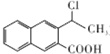 为起始原料制备
为起始原料制备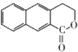 的合成路线
的合成路线 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com