
下列物质中只含有离子键的是_______;只有共价键的是_______;既含有离子键又含有共价键的是_________;含有非极性键的是______;既含有极性键又含有非极性键的是__________。
(A)CO2 (B)NaBr (C)NaOH (D)Na2O2 (E)H2O2 (F)H2S (G)MgCl2 (H)NH4Cl
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源:2015-2016学年湖北省高二下期中化学试卷(解析版) 题型:选择题
在密闭容器中,将2.0mol CO和10mol H2O混合加热到800℃,达到下列平衡:CO(g)+H2O(g) CO2(g)+H2(g) K=1.0。则有关该平衡的说法正确的是( )
CO2(g)+H2(g) K=1.0。则有关该平衡的说法正确的是( )
A.CO转化为CO2的转化率为83%
B.平衡时,H2O(g)的浓度为8.34mol/L
C.已知该反应在427℃时的平衡常数为9.4,则该反应为吸热反应
D.改变该平衡体系的温度、压强或各组分的浓度,该平衡一定能发生移动
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏中卫一中高一下第三次月考化学试卷(解析版) 题型:填空题
已知乳酸的结构简式为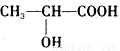 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称)。
(2)乳酸与金属钠反应的化学方程式为______________________________________________。
(3)乳酸与Na2CO3溶液反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏中卫一中高一下第三次月考化学试卷(解析版) 题型:选择题
在一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1 mol,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了0.1 mol,则反应速率为
A.v(H2)=0.03 mol/(L•min) B.v(N2)=0.02 mol/(L•min)
C.v(NH3)=0.17 mol/(L•min) D.v(NH3)=0.01 mol/(L•min)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古平煤高中高一实验班下期中化学卷(解析版) 题型:填空题
向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:
xA(g)+yB(g) pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
pC(g)+qD(g) 已知:平均反应速率vC=1/2vA;反应2min时,A的浓度减少了1/3,B的物质的量减少了a/2 mol,有a mol D生成.回答下列问题:
(1)反应2min内,vA=________________,vB=________________;
(2)化学方程式中,x=_____、y=_____、p=______、q=________;
(3)反应平衡时,D为2amol,则B的转化率为________________;
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古平煤高中高一实验班下期中化学卷(解析版) 题型:选择题
下图是元素周期表中短周期的一部分,B、C、D、F四种元素的原子核外最外层电子数之和等于C、D元素的原子序数之和。下列说法不正确的是( )

A.B元素形成的气态氢化物分子的空间结构是三角锥形
B.气态氢化物的稳定性C>E的原因是C分子间存在氢键
C.EF2分子中各原子的最外层均满足8电子稳定结构
D.A的单质均能溶于热的B或E的最高价氧化物的水化物的浓溶液中
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古平煤高中高一实验班下期中化学卷(解析版) 题型:选择题
下列一定是放热反应的是( )
A.氧化还原反应 B.离子反应 C.复分解反应 D.缓慢氧化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高一下期中化学试卷(解析版) 题型:简答题
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
I.已知: ① 4HCl(g)+O2(g) 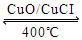 2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
②H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol
由知断开1mol H-H键所需能量为436kJ;断开1molO=O键所需能量为496kJ;断开1molCl-Cl键所需能量为243KJ。则
(1)H2与O2反应生成气态水的热化学方程式是
(2)断开1molH-O键所需能量为 kJ。
Ⅱ.已知: CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJ•mol-1 ①
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJ•mol-1 ②
又知CH4的燃烧热为890.3kJ/mol。
(1)利用上述已知条件写出甲烷完全燃烧的热化学方程式: 。
(2)以甲烷为原料制取氢气是工业上常用的制氢方法,CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________。
(3)高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中B表示的微粒是_______(填名称),等质量的A、H2化学能较低的物质是_______(填化学式)。

查看答案和解析>>
科目:高中化学 来源:2016年全国普通高等学校招生统一考试化学(浙江卷参考版) 题型:实验题
无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:

步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5 MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。
实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com