
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL lmol/L的NaOH 溶液,然后用lmol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是
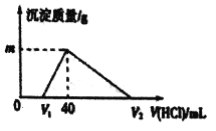
A. 原合金质量为0.92g
B. 图中V2的值为60mL
C. 产生氢气的体积为1120mL
D. 图中m的值为1.56g
【答案】D
【解析】钠铝合金置于水中,合金全部溶解,发生反应:2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,得到lmol/L的NaOH 溶液20mL,故剩余NaOH为0.02L×1mol/L=0.02mol;用盐酸滴定,依次发生:NaOH+HCl═NaCl+H2O、NaAlO2+HCl+H2O═NaCl+Al(OH)3↓、Al(OH)3↓+3HCl═AlCl3+3H2O.则:
NaOH+HCl═NaCl+H2O,
0.02mol 0.02mol
故V1=![]() =0.02L=20mL,
=0.02L=20mL,
生成沉淀时消耗的盐酸为40mL-20mL=20mL,其物质的量为0.02L×1mol/L=0.02mol,
NaAlO2+HCl+H2O═NaCl+Al(OH)3↓
0.02mol0.02mol 0.02mol
A.由钠元素及铝元素守恒可知,合金的质量为0.04mol×23g/mol+0.02mol×27g/mol=1.46g,故A错误;B.由Al(OH)3↓+3HCl═AlCl3+3H2O可知,溶解沉淀需要0.06molHCl,其体积为60mL,则V2为40mL+60mL=100mL,故B错误;C.由2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,生成氢气的物质的量为0.02mol+0.03mol=0.05mol,标况的体积为0.05mol×22.4L/mol=1.12L=1120mL,选项中没有指明气体的状态,故C错误;D.由上述计算可知,生成沉淀为0.02mol,其质量为0.02mol×78g/mol=1.56g,故D正确;故答案为D。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】下列各组离子,能大量共存于同一溶液中的是( )
A. CO32-、H+、Na+、NO3- B. H+、Ag+、Cl-、SO42-
C. K+、Na+、OH-、NO3- D. Ba2+、Ca2+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中每种物质都是含有共价键的离子化合物一组是( )
A. H2SO4、(NH4)2SO4 B. Na2SO4、HNO3
C. Na2O2、KOH D. HCl、Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素。其配方如下:其中花卉根细胞吸收最少的离子是:
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3- | H2PO4- | SO42- | Zn2+ |
培养液浓度(mmol/L) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
A. Ca2+ B. SO42- C. Zn2+ D. H2PO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的 ![]() )、H2和O2的混合气体,在标准状态下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为( )
)、H2和O2的混合气体,在标准状态下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为( ) 
A.2:7
B.5:4
C.2:1
D.7:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列玻璃仪器的洗涤方法涉及氧化还原反应的是
A. 附有银镜的试管用稀硝酸清洗B. 附有油脂的烧杯用热纯碱溶液清洗
C. 附有苯酚的试管用热的烧碱溶液清洗D. 附有氢氧化铁的试管用盐酸清洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将40 g氢氧化钠溶于水中,配制成1 L溶液,则该溶液的物质的量浓度为( )
A. 0.1 mol·L-1 B. 0.5 mol·L-1 C. 4 mol·L-1 D. 1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com