
| A. | CuCl2( H2O) | B. | NaOH(Na2O) | C. | CuSO4( CuO) | D. | NaCl( NaOH) |
分析 电解池中,要想使电解质溶液恢复,遵循的原则是:电解后从溶液中减少的物质是什么就利用元素守恒来加什么,据此分析.
解答 解:A.电解CuCl2溶液时一极析铜,另一极产生氯气,应再加入适量的CuCl2才能使电解质溶液与原来完全一样,故A错误;
B.电解NaOH溶液阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O,实际上被电解的是水,应加入水才能使电解质溶液与原来完全一样,故B错误;
C.电解CuSO4溶液,阴极Cu2++2e-=Cu,阳极4OH--4e-=O2↑+2H2O,加入CuO或是CuCO3,能使电解质溶液与原来完全一样,故C正确;
D.电解NaCl溶液,2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,一极析出氯气,另一极产生氯气,应再加入适量的HCl才能使电解质溶液与原来完全一样,故D错误.
故选C.
点评 本题考查电解原理,题目难度中等,解答本题的关键是能正确判断电极反应,根据析出什么加入什么的原则判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测氢氧化钠溶液的体积(ml) | 0.1000mol?L-1盐酸的体积(ml) |
| 第一次 | 25.00 | 26.11 |
| 第二次 | 25.00 | 28.74 |
| 第三次 | 25.00 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
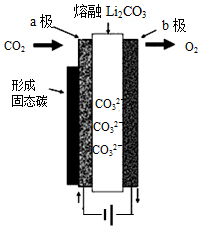 2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )
2010年乔治华盛顿大学Licht和他的合作者设计的捕获二氧化碳的电化学部分装置如图所示.下列说法正确的是( )| A. | 化学能转变为电能 | |
| B. | 阴极的电极反应为:CO2+4e-=C↓+2O2- | |
| C. | 阳极的电极反应为:2CO32--4e-=2CO2↑+O2↑ | |
| D. | 阴极上每通过4mole-,阴极区有1molCO2参与反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液 | B. | AlCl3溶液 | C. | MgCl2溶液 | D. | BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molH2O含有的原子数目为1.5NA | B. | 0.5molNH3含有的电子数目为4NA | ||
| C. | 28gCO含有的分子数目为NA | D. | 2NA个氯气分子的物质的量是2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和氢气分别在氯气中燃烧,都产生白色烟雾 | |
| B. | 铜丝在氯气中燃烧,生成蓝色的氯化铜 | |
| C. | 液氯和氯水中滴入硝酸银溶液均会产生白色沉淀 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液后溶液呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol、0.60 mol、0.20mol | B. | 0.30 mol、0.60 mol、0.10 mol | ||
| C. | 0.40 mol、0.60 mol、0.10 mol | D. | 0.20 mol、0.10mol、0.60 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com