
 美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如图:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| 实验编号 | N(CO) | N(H2O) | n(H2) | N(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
| x2 |
| (1-x)2 |
| 0.5mol |
| 1mol |
| 2×3 |
| 1×5 |
| 1×1 |
| 2×2 |
| 1×1 |
| 0.5×2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、常温下,pH=6的由醋酸与醋酸钠组成的混合溶液中:c(Na+)>c(CH3COO-) |
| B、将Cl2通入过量KOH溶液中:c(ClO-)+c(Cl-)=c(K+) |
| C、0.1mol?L-1的Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D、室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,向0.25mol?L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol?L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )| A、硫酸溶液的体积为20 mL |
| B、b时刻溶液中硫酸根离子浓度约为0.125 mol?L-1 |
| C、d时刻溶液的pH为13 |
| D、溶液的导电能力:c<d<b<a |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol硫酸钾中阴离子所带电荷数为NA |
| B、常温下,2.7克铝与足量的稀硫酸反应,失去的电子数为0.1NA |
| C、在常温下,把100 g CaCO3加到1 L水中,所得溶液中的Ca2+ 数等于NA |
| D、在标准状况下,22.4 L CH4与18 g H2O所含有的电子数均为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、许多化学反应中的能量变化表现为热量的放出和吸收 |
| B、化学键的断裂和形成是化学反应中能量变化的主要原因 |
| C、无需加热的反应一定是放热反应 |
| D、恒温、恒压条件下的反应热叫做焓变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、适量的稀硫酸 |
| B、适量的NaCl溶液 |
| C、适量的氨水 |
| D、适量的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
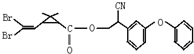 拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述不正确的是( )
拟除虫菊酯是一类高效,低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图.下列对该化合物叙述不正确的是( )| A、能被酸性高锰酸钾氧化 |
| B、属于卤代烃 |
| C、难溶于水 |
| D、在一定条件下可以发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com