
【题目】研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是( )

A.用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀
B.②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C.③中采用了牺牲阳极的阴极保护法保护桥墩
D.①②③中海水均是实现化学能与电能相互转化的电解质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氟铝酸钠(Na3AlF6)是工业炼铝中重要的含氟添加剂。实验室以氟石(CaF2)、石英和纯碱为原料模拟工业制备氟铝酸钠的流程如下:

(1) “煅烧”时,固体药品混合后应置于________(填仪器名称)中加热。
(2) 通过控制分液漏斗的活塞可以调节添加液体的速率。调溶液pH接近5时,滴加稀硫酸的分液漏斗的活塞应如下图中的________(填序号)所示。

(3) 在酸性废水中加入Al2(SO4)3、Na2SO4混合溶液,可将废水中F-转换为氟铝酸钠沉淀。
① 该混合溶液中,Al2(SO4)3与Na2SO4的物质的量之比应≥________(填数值)。
②在不改变其他条件的情况下,加入NaOH调节溶液pH。实验测得溶液中残留氟浓度和氟去除率随溶液pH的变化关系如图所示。pH>5时,溶液中残留氟浓度增大的原因是________。
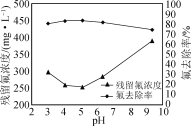
(4) 若用CaCl2作为沉淀剂除去F-,欲使F-浓度不超过0.95 mg·L-1,c(Ca2+)至少为________mol·L-1。[Ksp(CaF2)=2.7×10-11]
(5) 工业废铝屑(主要成分为铝,少量氧化铁、氧化铝)可用于制取硫酸铝晶体[Al2(SO4)3·18H2O]。
①请补充完整由废铝屑为原料制备硫酸铝晶体的实验方案:取一定量废铝屑,放入烧杯中,____________________________________________________________,得硫酸铝晶体。[已知:pH=5时,Al(OH)3沉淀完全;pH=8.5时,Al(OH)3沉淀开始溶解。须使用的试剂:3 mol·L-1 H2SO4溶液、2 mol·L-1 NaOH溶液、冰水]
②实验操作过程中,应保持强制通风,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用调味剂花椒油是一种从花椒籽中提取的水蒸气挥发性香精油,溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。
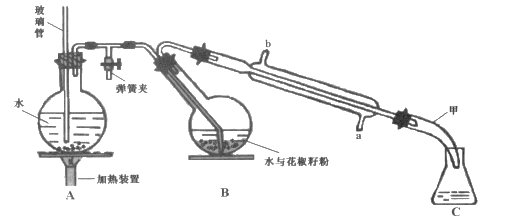
实验步骤:
(一)在A装置中的圆底烧瓶中装入![]() 容积的水,加1~2粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加1~2粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
(二)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏。
(三)向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体倾倒入蒸馏烧瓶中,蒸馏得花椒油。
(1)装置A中玻璃管的作用是_______。装置B中圆底烧瓶倾斜的目的是 ________。
(2)步骤(二)中,当观察到_______现象时,可停止蒸馏。蒸馏结束时,下列操作的顺序为_______(填标号)。
①停止加热②打开弹簧夹③关闭冷凝水
(3)在馏出液中加入食盐的作用是__ ;加入无水Na2SO4的作用是_______。
(4)实验结束后,用稀NaOH溶液清洗冷凝管,反应的化学方程式为_________。(残留物以![]() 表示)
表示)
(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加80.00mL0.5mol/LNaOH的乙醇溶液,搅拌,充分反应,加水配成200mL溶液。取25.00mL加入酚酞,用0.1moI/L盐酸进行滴定,滴定终点消耗盐酸20.00mL。则该花椒油中含有油脂_______ g/L。
(以 计,式量:884)。
计,式量:884)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏,还是各种炉气、尾气、副产气,进行分离回收和提浓,合理利用,意义重大。
(1)在空间站中常利用CO2(g)+2H2(g)![]() C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
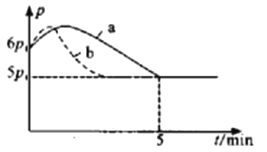
①若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强(p)随时间(t)的变化如图中a所示,则上述反应的△H___________0(填“>”或“<”);其他条件相同时,若仅改变某一条件,测得其压强(p)随时间(t)的变化如图中曲线b所示,则改变的条件是___________。
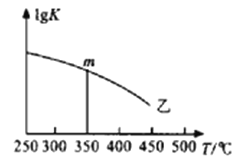
②图是反应平衡常数的对数与温度的变化关系图,m的值为___________。
(2)CO2在 Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
Ⅰ.CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H1<0
CH3OH (g)+H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H2>0
CO(g)+ H2O(g) △H2>0
保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:
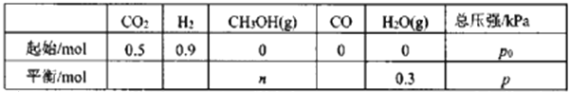
若反应I、II均达平衡时,p0=1.4p,则表中n=__________;反应1的平衡常数Kp=____ (kPa)-2。(用含p的式子表示)
(3)Al-CO2电池是一种以低温熔融盐[Al2(CO3)3]为电解质,以完全非碳的钯Pd包覆纳米多孔金属为催化剂正极的可充电电池。正极反应为:3CO2+4e-=2CO32-+C,则生成Al的反应发生在___________极(填“阳”或“阴”),该电池充电时反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下, 反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数![]() 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如图所示:下列判断不正确的是
起始量 | 甲 | 乙 | 丙 |
H2 (mol) | 1 | 2 | 2 |
CO2(mol) | 1 | 1 | 2 |
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C.平衡时,乙中H2的转化率大于60%
D.平衡时,丙中c(H2 ) 是0. 08 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
A.x=1B.B的转化率为40%
C.2 min内A的反应速率为0.2 mol·L-1·min-1D.若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJmol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJmol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJmol-1
A.H2(g)的燃烧热为571.6 kJmol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+H2O(l) ΔH=-57.3 kJmol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.将纯水加热到95 ℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量碳酸钠固体,影响水的电离平衡,c(H+)减小,Kw不变
D.向纯水中加入醋酸钠固体或盐酸,均可抑制水的电离,Kw不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com