
下列依据相关实验得出的结论正确的是
A.将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3
B.将某气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2
C.取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+
D.在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解
科目:高中化学 来源:2014-2015学年重庆市高三下学期第二次质量检测理综化学试卷(解析版) 题型:实验题
(14分)已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
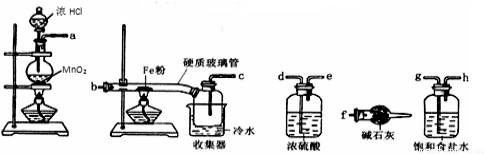
(1)装置的连接顺序为 。
(2)饱和食盐水的作用是 。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
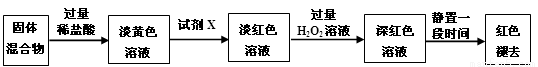
①淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_____________________。
②淡红色溶液中加入过量H2O2后溶液红色加深的原因是 。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组同学对红色褪去的原因进行探究。
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀HCl和BaCl2溶液,产生白色沉淀。
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。
实验①说明 ;
实验②的目的是 ;
得出结论:溶液褪色的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:填空题
(14分)(I)已知X.Y.Z.W为短周期四种常见元素,共中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应。试回答下列问题:
(1)请写出下列元素的名称:Y____________,W____________.
(2)请写出X2Z2的电子式________________.
(3)请写出W元素的单质与NaOH溶液反应的离子方程式____________.
(II)A是由X、 Y、 Z和Cu四种元素组成的绿色固体,发生如下图所示转化(反应条件及部分产物已略去)。
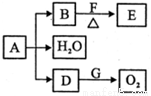
常温下,D为无色无味气体,B为黑色粉末,75%的F水溶液常做医用消毒剂。请回答下列问题:
(4)D跟G反应的化学方程式____________________.
(5)E中含有官能团的名称__________。请写出检脸E中官能团的化学方程式_ ______________。.
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
下列解释不科学的是
A.“水摘石穿”是溶解了CO2的雨水与CaCO3 长期作用生成了可溶性的Ca(HCO3)2的缘故
B.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成和从石油中提取的柴油成分完全相同的生物柴油
C.长期盛放NaOH溶液的滴瓶不易打开,主要是由于NaOH能与玻璃中的SiO2反应生成硅酸钠导致瓶塞与瓶口粘住的缘故
D.黄铜(铜锌合金)不易产生铜绿,这是因为发生电化学腐蚀时,锌被腐蚀而保护了铜。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省绥化市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2 气体,立即通入一定浓度的Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42 -、SO32 -、HSO3- 中的一种或几种 |
C |
| 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:填空题
(16分)工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca,Mg元素)为原料生产碳酸锂。其部分工业流程如下:
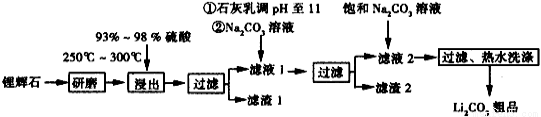
已知:①Li2O·Al2O3·4SiO2 + H2SO4(浓)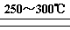 Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
②某些物质的溶解度(S)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣1中分离出Al2O3部分的流程如下图所示,括号表示加入的试剂,方框表示所得的物质。则步骤Ⅱ中反应的离子方程式是______________________________。

(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)_____________________________。
(3)最后一个步骤中,用“热水洗涤”的目的是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________。
②电解后,LiOH溶液浓度增大的原因_____,b中,生成Li2CO3反应的化学方程式是_______。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。
LiFePO4,电池中的固体电解质可传导Li+试写出该电池放电时的正极反应:__________________。若用该电池电解饱和食盐水(电解池电极均为惰性电极)当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为__________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:选择题
下列叙述不正确的是
A.NH4Cl溶液加水稀释后,恢复至原温度,pH和KW均增大
B.0.1 mol/L CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.pH=4的CH3COOH溶液和pH=4的NH4Cl溶液中,c(H+)相等
D.在NaHCO3溶液中:c(OH—)+c(CO32—)=c(H+)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015吉林省松原市高一下学期第一次月考化学试卷(解析版) 题型:选择题
阴离子Xn-含中子N个,X的质量数为A,则a g X的氢化物中含质子的物质的量是
A.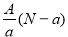 mol B.
mol B.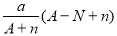 mol
mol
C.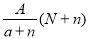 mol D.
mol D.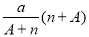 mo1
mo1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安地区八校高三下学期联考三理综化学试卷(解析版) 题型:填空题
(14分)SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
(1)高温条件下,SiHCl3与氢气反应的方程式为: 。
(2)已知:
(ⅰ)Si(S)+4HCl(g)=SiCl4(g)+2H2(g) △H=-241KJ.mol-1
(ⅱ)Si(S)+3HCl(g)=SiHCl3(g)+H2(g) △H=-210KJ.mol-1
则SiCl4转化为SiHCl3的反应(ⅲ):3SiCl4(g)+2H2(g)+Si(S)==4SiHCl3(g) △H=______。
(3)力研究反应(iii)的最适宜反应温度,下图为四氯化碳的转化率随温度的变化曲线:由图可知该反应最适宜的温度为 ,四氯化碳的转化率随温度升高而增大的原因为____。
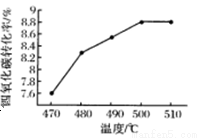
(4)一定条件下,在2L恒容密闭容器中发生反应(ⅲ),6h后达到平衡,H2与SiHCl3的物质的量浓度分别为1mol.L-1和0.2 mol.L-1
①从反应开始到平衡,v(SiCl4)=___________。
②该反应的平衡常数表达式为K= ,温度升高,K值 (填“”增大”、“减小”或“不变”)。
③原容器中,通入H2的体积(标准状况下)为 。
④若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),当反应再次达到平衡时,与原平衡相比较,H2的体积分数将 (填“增大”、“减小”或“不变”).
⑤平衡后,将容器的体积压缩为1L,再次达到平衡时,H2的物质的量浓度范围为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com