
| Ԫ�ش��� | X | Y | Z | M | R |
| ԭ�Ӱ뾶/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| ��Ҫ���ϼ� | +1 | +6-2 | +5-3 | -2 | +3 |
 ��������ѧ���������Ӽ������ۼ���
��������ѧ���������Ӽ������ۼ������� �ɻ��ϼۿ�֪Y���ϼ���+6��-2�ۣ�ӦΪ��A��Ԫ�أ�ΪSԪ�أ�M���ϼ�ֻ��-2�ۣ�ΪOԪ�أ�Z���ϼ�Ϊ+5��-3��Ϊ��A��Ԫ�أ���ԭ�Ӱ뾶����OС��S��ӦΪNԪ�أ�X���ϼ�Ϊ+1�ۣ�Ϊ��A��Ԫ�أ�ԭ�Ӱ뾶����S��ΪNaԪ�أ�RΪ+3�ۣ����ڢ�A��Ԫ�أ�ԭ�Ӱ뾶С��Na������S��ΪAlԪ�أ�
��1�����ݷ�����֪RΪ��Ԫ�أ�����Ԫ��������=���Ӳ���������������=�������������ݴ��ж�̼Ԫ�������ڱ���λ�ã�
��2��X��Y��ԭ�Ӹ�����1��1���ɵ�����ΪNa2S2�������������ӻ���������������������ӹ��ɣ�����������к��й��ۼ���
��3�����Ӳ���Խ�࣬�뾶Խ���Ӳ�����ͬʱ���˵����Խ��뾶ԽС��
��4��SO2����ͨ��FeCl3��Һ�з�Ӧ�����������������
��5����Cu������������ʯī��������CuΪ���Ե缫������������Ӧ��ʧȥ��������ͭ������Ӧ����������ͭ��
��� �⣺�ɻ��ϼۿ�֪Y���ϼ���+6��-2�ۣ�ӦΪ��A��Ԫ�أ�ΪSԪ�أ�M���ϼ�ֻ��-2�ۣ�ΪOԪ�أ�Z���ϼ�Ϊ+5��-3��Ϊ��A��Ԫ�أ���ԭ�Ӱ뾶����OС��S��ӦΪNԪ�أ�X���ϼ�Ϊ+1�ۣ�Ϊ��A��Ԫ�أ�ԭ�Ӱ뾶����S��ΪNaԪ�أ�RΪ+3�ۣ����ڢ�A��Ԫ�أ�ԭ�Ӱ뾶С��Na������S��ΪAlԪ�أ�
��1��MΪOԪ�أ�O��ԭ������Ϊ8�����������Ų�Ϊ1s22s22p4����OԪ��λ�����ڱ��еڶ����ڵ�VIA�壬
�ʴ�Ϊ��Al���ڶ����ڵ�VIA�壻
��2��X��Y��ԭ�Ӹ�����1��1���ɵ�����ΪNa2S2�������������ӻ���������������������ӹ��ɣ�����ʽ ����ԭ��֮��ͨ�����õ��Ӷ��γɹ��ۼ���������ѧ������Ϊ���Ӽ������ۼ���
����ԭ��֮��ͨ�����õ��Ӷ��γɹ��ۼ���������ѧ������Ϊ���Ӽ������ۼ���
�ʴ�Ϊ�� �����Ӽ������ۼ���
�����Ӽ������ۼ���
��3��X+��Y2?��M2?���ӷֱ�ΪNa+��S2?��O2?�����Ӳ���Խ�࣬�뾶Խ��S2?���Ӳ�����࣬���Ӳ�����ͬʱ���˵����Խ��뾶ԽС�������Ӱ뾶��С˳��ΪS2?��O2?��Na+��
�ʴ�Ϊ��S2?��O2?��Na+��
��4����Ӧ�����������������ᣬ��SO2����ͨ��FeCl3��Һ�е����ӷ�ӦΪ��2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+��
�ʴ�Ϊ��2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+��
��5��X������������Ӧ��ˮ����NaOH��CuΪ���Ե缫������������Һ�����Һ���е�⣬����ͭʧȥ��������������ͭ���缫��ӦʽΪ��Cu+2OH?-2e?=Cu��OH��2��
�ʴ�Ϊ��Cu+2OH--2e-=Cu��OH��2��
���� ���⿼��ԭ�ӽṹ��Ԫ�������ɵĹ�ϵ����Ŀ�Ѷ��еȣ���ȷ����Ԫ�ػ��ϼۡ�ԭ�Ӱ뾶��Ԫ�����ʵĹ�ϵ�ǽ�����Ĺؼ���ע��Ԫ�������ɵĵݱ���ɵ�Ӧ�ã�����������ѧ���ķ���������������������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| ���� | �¶�/k | ���ʵ���ʼŨ��/mol•L-1 | ���ʵ�ƽ��Ũ��/mol•L-1 | ||
| c��H2���� | c��CO���� | c��CH3OH���� | c��CH3OH���� | ||
| �� | 400�� | ��0.20 | ��0.10 | ��0 | 0.080�� |
| �� | ��400 | ��0.40 | ��0.20 | ��0 | |
| �� | ��500 | ��0 | 0�� | 0.10�� | 0.025 |
| A�� | �÷�Ӧ������Ӧ���� | |
| B�� | �ﵽƽ��ʱ������I�з�Ӧ��ת���ʱ��������е�С | |
| C�� | �ﵽƽ��ʱ����������c��H2�������������е����� | |
| D�� | �ﵽƽ��ʱ���������е�����Ӧ���ʱ�����I�еĴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L 0.1mol/L NaHSO3��Һ�к���HSO3-������Ϊ0.1NA | |
| B�� | 50 mL 18.4 mol•L-1Ũ����������ͭ��Ӧ������SO2������Ϊ0.46 NA | |
| C�� | 1 mol H2��1 mol I2��ַ�Ӧ���ɵõ�HI������Ϊ2NA | |
| D�� | 2.2 g CO2������þ�۷�Ӧ��ת�Ƶ�����Ϊ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����þ�۵�ߣ��������������²��� | |
| B�� | �����������ԣ�����������ˮ��ɱ������ | |
| C�� | ��֬�ڼ���������ˮ�⣬��������Ӳ���� | |
| D�� | ������۵�ߡ�Ӳ�ȴ����������뵼����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
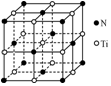 TiO2��һ�����������İ뵼������������Ч�ؽ��л���Ⱦ����ȩ���ױ��ȣ��ͺ����������NH3��CN-�ȣ�ת��ΪCO2��N2��С�������ʣ�
TiO2��һ�����������İ뵼������������Ч�ؽ��л���Ⱦ����ȩ���ױ��ȣ��ͺ����������NH3��CN-�ȣ�ת��ΪCO2��N2��С�������ʣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2��D2��Ϊͬλ�� | |
| B�� | 12Cԭ����ָ������Ϊ6����������12��һ�ֺ��� | |
| C�� | 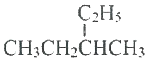 ��������2-�һ����� ��������2-�һ����� | |
| D�� | ����ʽΪC2H6O��C4H10���л����������ͬ���칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
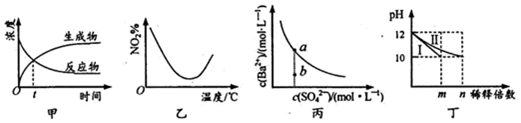
| A�� | ͼ�ױ�ʾij���淴Ӧ������Ũ����ʱ��ı仯����Ӧ��tʱ�̴ﵽƽ��״̬ | |
| B�� | ͼ�ұ�ʾNO2�ں����ܱ������з�����Ӧ��2NO2��g��?N2O4��g����NO2����������¶ȵı仯���ߣ���÷�Ӧ������Ӧ��H��O | |
| C�� | ͼ����ʾij�¶�ʱ��BaSO4��ˮ�е��ܽ�ƽ�����ߣ�����ˮ��ʹ��Һ��b��䵽a�� | |
| D�� | ͼ����ʾ�ֱ�ϡ��l0mLpH��Ϊ12��NaOH��NH3•H2O��ҺʱpH�ı仯������I��ʾNH3•H2O��Һ��n��100 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����ԭ������������Ԫ�ص���Ҫ���ϼ������� | |
| B�� | �����������ԭ������������Ԫ�صĻ�ѧ���ʻ���ظ� | |
| C�� | ��������ȣ�����������ģ��������������и�С���ܶȺ�Ӳ�� | |
| D�� | ±���⻯����ȶ������ź˵���������Ӷ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com