
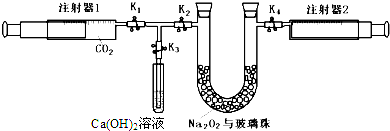


科目:高中化学 来源: 题型:
| A、生成了一种强酸弱碱盐 |
| B、等浓度的强酸和弱碱溶液反应 |
| C、浓的弱酸溶液和稀的强碱溶液反应 |
| D、浓的强酸和稀的强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
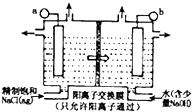 ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol SiO2晶体中有2NA个Si-O键 |
| B、0.5 mol I-被氧化时失去的电子数为0.5NA |
| C、在0℃,压强为1.01×105 Pa时,11.2 L SO3所含原子数目为2NA |
| D、常温常压下,48 g O3含有氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点/℃ | 沸点/℃ |
| SiCl4 | -70 | 57.6 |
| TiCl4 | -25 | 136.5 |
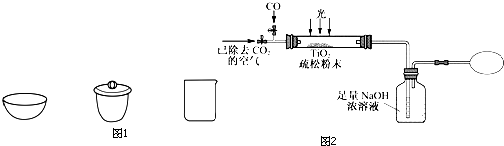
查看答案和解析>>
科目:高中化学 来源: 题型:
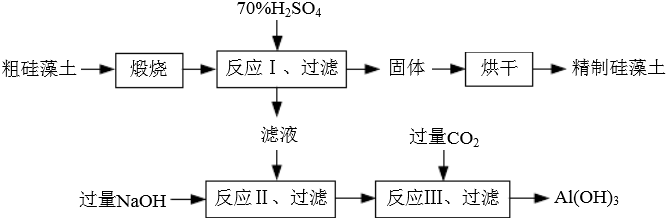
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ca2+、K+、OH-、Cl-、NO3- |
| B、Fe2+、H+、Br+、NO3-、Cl- |
| C、Na+、NH4+、SO42-、NO3-、Cl- |
| D、Al3+、H+、Cl-、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④ | B、②③⑤ |
| C、①④⑤ | D、②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com