
| A. | 0 | B. | 175 | C. | 57 | D. | 118 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜是还原剂,发生了氧化反应 | |
| B. | 每生成64 g SO2,转移电子的物质的量是2 mol | |
| C. | 每消耗1 mol Cu,起氧化剂作用的硫酸消耗2 mol | |
| D. | 在此反应中,浓硫酸表现出酸性和氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为焦炭,则丁可能是O2 | B. | 若甲为SO2,则丁可能是氨水 | ||
| C. | 若甲为Fe,则丁可能是盐酸 | D. | 若甲为NaOH溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
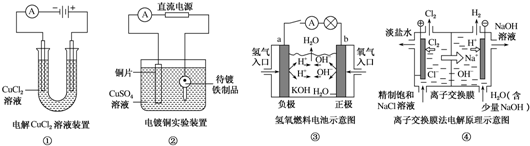
| A. | ①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝 | |
| B. | ②装置中待镀铁制品应与电源正极相连 | |
| C. | ③装置中电子由b极流向a极 | |
| D. | ④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. ;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
;A可与水反应生成刺激性气味且能使品红溶液褪色的气体及其他生成物,写出该反应化学方程式:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 一氯取代物有5种 | B. | 二氯取代物有8种 | C. | 可发生水解反应 | D. | 该物质中有羰基 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com