
在一个U形管里盛有CuCl2溶液,并插入两块锌片作电极,按如图连接。
(1)如果把电键K接A,该装置应是电解装置,Zn①极是 极,电极反应式为 ,Zn②极是 极,电极反应式为 。
(2)上述反应进行5 min后,转换电键K到C,则这个装置是原电池装置,Zn①极是 极,电极反应式为 。
(3)上述装置进行2 min后,再转换电键K到B,则Zn①极发生的化学反应为 ,Zn②极发生的有关电化学的反应为 。
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:填空题
(10分) 如图所示装置: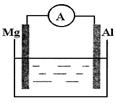
(1)若烧杯中溶液为稀硫酸,则观察到的现象为: 。
两极反应式为:正极 ;负极 。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为 ,
总反应方程为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)如图 是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
(1)当电极a为Al、电极b为Mg、电解质溶液为稀硫酸时,正极的电极反应式为____________;负极的电极反应式为____________。
(2)当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该装置__________(填“能”或“不能”)形成原电池。若不能,请说明理由;若能,请说明在两电极上所发生的现象:________。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,氢氧化钠溶液为电解质溶液。则氢气应通入________(填“a”或“b”)极,正极上的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
按下图所示装置进行实验,并回答下列问题: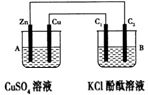
(1)判断装置的名称:A池为 ,B池为 。
(2)锌极为 极,电极反应式为 ;铜极为 极,电极反应式为 ;石墨棒C1为 极,电极反应式为 ;石墨棒C2附近发生的实验现象为 ,反应结束后,B池溶液的pH值 。(增大、减小、不变,忽略气体溶于水) 。
(3)当C2极析出224 mL气体(标准状况下),锌的质量 (增加或减少) g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A. ,B. 。(填“能”或“不能”)
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:
①下列说法正确的是 。
A.甲、乙均为化学能转变为电能的装置
B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少
D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲 乙(填“>”、“<“或“=” )
③请写出图中构成原电池的负极电极反应式 。
④当乙中产生1.12L(标准状况)气体时,将锌、铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为 。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入 极(填a或b,下同),电子从 极流出。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
依据氧化还原反应2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如下图所示。请回答下列问题:
(1)电极X的材料是 ,电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ; X电极上发生的电极反应为 。
(3)外电路中的电子是从 电极流向 电极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请按要求回答下列问题。

(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示的装置,在盛有水的烧杯中,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡。小心地往烧杯中央滴入CuSO4溶液。
(1)片刻后可观察到的现象是(指悬吊的金属圈)________。
| A.铁圈和银圈左右摇摆不定 |
| B.保持平衡状态不变 |
| C.铁圈向下倾斜 |
| D.银圈向下倾斜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com