
分析 (1)14.51克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与硝酸,BaCO3溶于硝酸,故白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66g为BaSO4的质量,可得BaCO3的质量为14.51g-4.66g=9.85g,根据n=$\frac{m}{M}$计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量,再根据c=$\frac{n}{V}$计算原混和溶液中Na2CO3和Na2SO4的物质的量浓度,最后分别计算出原混合液中碳酸根离子、钠离子的浓度;
(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3),再根据V=nVm计算CO2的体积.
解答 解:(1)14.51克白色沉淀是BaCO3和BaSO4混合物,加入过量的稀HNO3,充分反应后,剩余沉淀4.66g为BaSO4,BaSO4的物质的量为:$\frac{4.66g}{233g/mol}$=0.02mol,由硫酸根守恒可知n(Na2SO4)=n(BaSO4)=0.02mol,所以Na2SO4物质的量的浓度为:$\frac{0.02mol}{0.05L}$=0.4mol/L,
减少的沉淀质量为BaCO3,故BaCO3的质量为14.51g-4.66g=9.85g,物质的量为:$\frac{9.85g}{197g/mol}$=0.05mol,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,所以Na2CO3的物质的量浓度为:$\frac{0.05mol}{0.05L}$=1mol/L,
则原混合液中CO32-的物质的量浓度为:c(CO32-)=c(Na2CO3)=1mol/L;
Na+的物质的量浓度为:c(Na+)=2c(Na2CO3)+2c(Na2SO4)=1mol/L×2+0.4mol/L×2=2.8mol/L,
故答案为:1mol/L;2.8mol/L;
(2)发生反应BaCO3+2HNO3═Ba(NO3)2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3)=0.05mol,故生成的二氧化碳的体积为:0.05mol×22.4L/mol=1.12L,
故答案为:1.12.
点评 本题考查混合物的有关计算,题目难度不大,明确反应过程理解沉淀质量减少的原因是关键,注意守恒思想的运用,试题培养了学生的化学计算能力.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
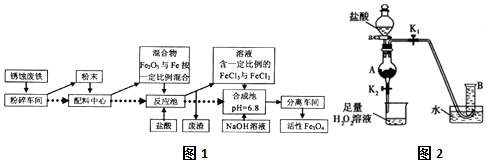
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应是指在同一条件下能同 时向正逆两个方向进行的反应 | |
| B. | 2HI$\stackrel{△}{?}$H2+I2是可逆反应 | |
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O与2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑互为可逆反应 | |
| D. | 只有可逆反应才存在化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
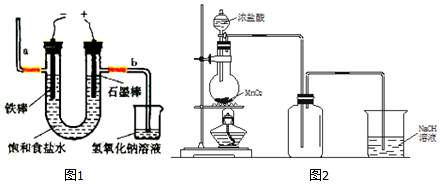
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核内有6个质子,核外有13个电子 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数为13,原子序数为6,核内有7个质子 | |
| D. | 质量数为13,原子序数为6,核内有7个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
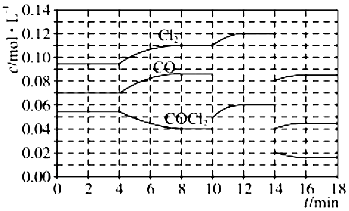 光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com