

分析 Ⅰ.A.根据碱性锌锰电池的电极反应判断;
B.根据银锌纽扣电池工作原理判断;
C.根据放电时铅酸蓄电池反应判断硫酸浓度变化;
D.电镀时,镀层金属阳离子放电.
Ⅱ.硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,据此可判断焙砂的主要成分;
(2)焙烧生成的含硫氧化物可转换为硫酸;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而出去Fe;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,以此判断阳极产物;
(5)硫化锌经过“氧压酸浸”反应生成二价锌离子、硫和水;
(6)碳酸锌与碳在高温下反应生成锌和一氧化碳,结合氧化还原反应得失电子守恒配平方程式.
解答 解:Ⅰ.A.碱性锌锰电池中,MnO2中Mn元素化合价降低,发生还原反应,作氧化剂,故A错误;
B.银锌纽扣电池工作时,Ag2O发生还原反应生成Ag,故B正确;
C.铅酸蓄电池总电池反应为:PbO2+2H2SO4+Pb$\frac{\underline{\;充电\;}}{放电}$2PbSO4+2H2O,可知放电时铅酸蓄电池硫酸浓度不断减小,故C错误;
D.电镀时,镀层阳离子在镀件放电形成镀层,化合价降低,发生还原反应,故D正确;
故答案为:BD;
Ⅱ.硫化锌精矿的焙烧可生成ZnO、氧化铁等,含尘烟气含有含硫氧化物,可用于制备硫酸,浸出液加入硫酸可生成硫酸锌、硫酸铁,加入过量锌充分反应,可置换出铁,滤液中主要含有硫酸锌,经电解可得到锌和硫酸,电解液中含有硫酸,可循环利用,
(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,则焙砂的主要成分为ZnO,
故答案为:ZnO;
(2)焙烧生成的含硫氧化物可转换为硫酸,用于后续的浸出操作,
故答案为:浸出;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉除去亚铁离子,从而出去Fe,
故答案为:Zn粉;置换出Fe等;
(4)电解沉积过程中,是电解ZnSO4,阳极发生氧化反应,产物为O2,
故答案为:O2;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,该反应的化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O,
故答案为:2ZnS+4H++O2=2Zn2++2S↓+2H2O;
(6)根据题目描述可知反应物为ZnCO3和C,产物含有Zn,反应的化学方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑,
故答案为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑.
点评 本题考查了物质分离与提纯方法及其综合应用,题目难度中等,涉及原电池与电解池工作原理、化学实验基本操作方法、化学方程式、离子方程式的书写等知识,明确实验目的、实验原理为解答关键,注意掌握常见物质分离与提纯方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH3+H2O,酯化(或取代)反应.
CH3COOCH2CH3+H2O,酯化(或取代)反应.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
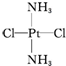 ,黄绿色固体
,黄绿色固体 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
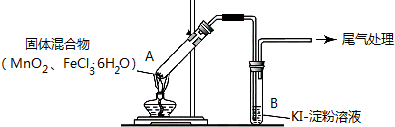
| 操作 | 现象 |
| 点燃酒精灯,加热 | i.A中部分固体溶解,上方出现白雾 ii.稍后,产生黄色气体,管壁附着黄色液滴 iii.B中溶液变蓝 |
| 方案1 | 在A、B间增加盛有某种试剂的洗气瓶C | B中溶液变为蓝色 |
| 方案2 | 将B中KI淀粉溶液替换为NaBr溶液;检验 Fe2+ | B中溶液呈浅橙红色;未检出Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
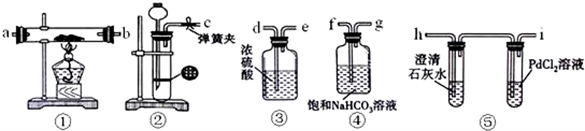
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,用pH计测量0.1mol•L-1FeCl3溶液的pH为a,再测量稀释10倍的0.01mol•L-1FeCl3溶液的pH为b,可判断出FeCl3水解程度与盐溶液浓度大小关系 | |
| B. | 将装有3~4mL无水乙醇的试管浸入50℃左右的热水中,将烧黑的铜丝迅速插入无水乙醇中,可观察到铜丝变红,反复数次,可闻到刺激性气味 | |
| C. | 向某溶液加浓NaOH溶液并微热,若产生的气体能使湿润的红色石蕊试纸变蓝,则说明此溶质为铵盐 | |
| D. | 酸碱中和滴定到终点读数时,发现滴定管尖嘴处悬挂一滴标准溶液,导致实验结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
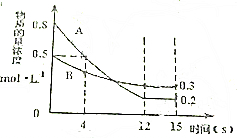 已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.
已知:反应aA(g)+bB(g)?cC(g)某温度下,在2L的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com