
常温下用0.10 mol /L KOH溶液,滴定0.10 mol /L CH3COOH溶液,有关滴定过程中的说法正确的是
A.滴定终点时:溶液的pH=7
B.滴定终点时:c(K+) = c(CH3COO-),c(H+) < c(OH-)
C.当溶液pH=7时:c(K+) = c(CH3COO-) + c(CH3COOH)
D.接近滴定终点时:c(K+) + c(H+) = c(CH3COO-) + c(OH-)
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:
(15分) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________
往Na2A溶液中加入 可抑制其水解
A NaOH固体 B 氯化铁固体 C 水 D 碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省汕头市金山中学高二12月月考化学试卷 题型:填空题
(15分) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________
往Na2A溶液中加入 可抑制其水解
A NaOH固体 B 氯化铁固体 C 水 D 碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源:2013届广东省汕头市高二12月月考化学试卷 题型:填空题
(15分) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_____________________________________________。
(2)Na2A的水溶液呈______性 ,原因是(用离子方程式表示):____________________
往Na2A溶液中加入 可抑制其水解
A NaOH固体 B 氯化铁固体 C 水 D 碳酸钠固体
已知Ksp(BaA)=1.8×10-10,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为__________ mol·L-1。(忽略A2—的水解)
(3)若溶液M由2 mol·L-1H2A溶液与2mol·L-1NaOH溶液等体积混合而得,若所得溶液M的pH<7,则溶液中离子浓度由大到小顺序为_____________。
(4)若溶液M由下列三种情况:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液,则三种情况的溶液中H2A分子浓度最大的为________;pH由大到小的顺序为____________。
(5)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液c(H+)/c(OH-)=104,V1与V2的大小关系为__________(填“大于”“等于”“小于”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
 CH3OH(g);ΔH
CH3OH(g);ΔH 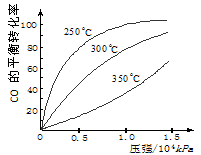
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题
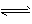 2NH3 ( g) △H = -a kJ . mol-1
2NH3 ( g) △H = -a kJ . mol-1 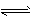 NH3(g) △H = -b kJ . mol-1
NH3(g) △H = -b kJ . mol-1 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com